第2章 慢性痛のメカニズム
Ⅰ 痛みを伝える情報伝達系

画像出展:「慢性痛のサイエンス」
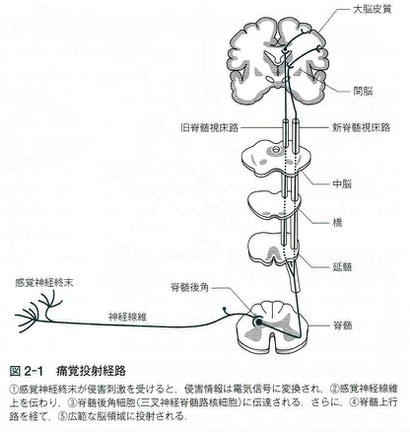
①感覚神経終末が侵害刺激を受けると、侵害情報は電気信号に変換され、②感覚神経線維上を伝わり、③脊髄後角細胞(三叉神経脊髄路核細胞)に伝達される。さらに、④脊髄上行路を経て、⑤広範な脳領域に投射される。
1)感覚神経終末:侵害・非侵害情報を電気信号に変換する
・熱刺激、機械的刺激、化学的刺激などにより体が侵襲を受けると、それらのエネルギーは感覚神経終末によって、電気信号に変換され、上位脳へ伝えられる。
・感覚神経終末には侵害情報を検出する様々な侵害受容体やイオンチャネルが存在している。
画像出展:「慢性痛のサイエンス」
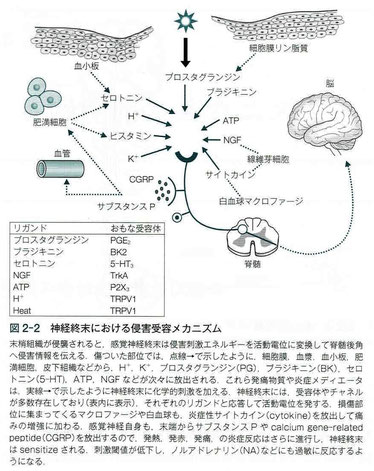
末梢神経が侵襲されると、感覚神経終末は侵害刺激エネルギーを活動電位に変換して脊髄後角へ侵害情報を伝える。傷ついた部位では、点線→で示したように、細胞膜、血漿、血小板、肥満細胞、皮下組織などから、H⁺、K⁺、プロスタグランジン(PG)、ブラジキニン(BK)、セロトニン(5-HT)、ATP、NGFなどが次々に放出される。これら発痛物質や炎症メディエータが多数存在しており(表内に表示)、それぞれのリガンドと応答して活動電位を発する。損傷部位に集まってくるマクロファージや白血球も、炎症性サイトカイン(cytokine)を放出して痛みの増強を加える。感覚神経自身も、末端からサブスタンスPやcalcium gene-related peptide(CGRP)を放出するので、発熱、発赤、発痛、の炎症反応はさらに進行し、神経終末はsensitizeされる。刺激閾値が低下し、ノルアドレナリン(NA)などにも過敏に反応するようになる。
2)脊髄後角と三叉神経脊髄路核:侵害・非侵害情報を伝達する
・痛みの情報を伝える体性感覚神経(一次感覚ニューロン)は、Aδ神経線維とC神経線維の2つの神経線維がある。
・Aδ神経線維は比較的低い刺激閾値を有する有髄神経線維で、局在のはっきりした、鋭くて速い痛みを伝える。多くは体表近くの皮膚に分布している。
・C線維は高い刺激閾値を有する無髄神経で、遅くて局在のはっきりしない痛みを伝えている。骨組織、歯髄などの深部組織、皮膚に分布している。
・Aβ神経線維は触感覚や振動情報を伝え、最も低い刺激閾値を有している。皮膚に何かが触れた、風が当たったなど、非侵害性の感覚情報を伝えている。
3)脊髄後角と三叉神経脊髄路核:侵害・非侵害情報を伝達する
・体性感覚神経(一次感覚ニューロン)を伝わった感覚信号は、脊髄後角や三叉神経脊髄路核で、二次感覚ニューロンに伝達される。

画像出展:「慢性痛のサイエンス」
脊髄後角の灰白質はⅠ層からⅥ層に分かれている。C神経線維は表層の辺縁細胞と、Aδ神経線維は膠様質細胞とシナプス形成して、侵害情報を伝達する。Aβ神経線維は非侵害情報をⅢ-Ⅵ層の細胞に伝達する。
4)脊髄上行路:新旧2つの投射経路
・侵害情報を伝える二次感覚神経は、脊髄後角細胞を出て対側の脊髄前側索を上行するが、脊髄伝導路は脳幹レベルで、内側系投射経路と外側系投射経路に分けれている。内側系は主として痛みの情動的側面に関与する神経核に情報を伝え、外側系は痛みの感覚的側面に関与する神経核に情報を与えている。
・内側系の旧脊髄視床路は、視床の内側・髄板内核群に達する原始的な経路で、「遅い体性感覚投射経路」を形成し、局在性のはっきりしない痛みの情報を伝えている。
・旧脊髄視床路は、脳幹網様体に多くの側枝を出しながら上行して、視床・髄板内核群ニューロンに終わっている。髄板内核群からは扁桃体、前帯状皮質、島皮質などの古い脳に広く侵害情報を投射している。
・旧脊髄視床路以外にも、脊髄腕傍核扁桃体投射、脊髄網様体路、脊髄中脳路などの侵害情報を伝える投射経路がある。
・慢性痛に関与するのは、主として辺縁系、大脳基底核、中脳などの古い脳の神経核である。
・新脊髄視床路は外側系と呼ばれる経路で、視床外側の腹側基底核群に達する。精緻で高度な局在性を有する「速い体性感覚投射経路」は、侵害情報を正確に迅速に、視床を経て大脳皮質中心後回の体性感覚野に伝えている。急性痛の部位や痛みの性質など正確に弁別できる。
・内側系、外側系の両投射系は平行して上行するが、いくつかの接点がある。例えば島皮質では、外側系によって運ばれた侵害情報が後部島皮質に入力され、それが中部島皮質を経て前部島皮質に伝達される過程で、内側系の情報(辺縁系などによる情動系要素)が加味され、統合された情報になる。
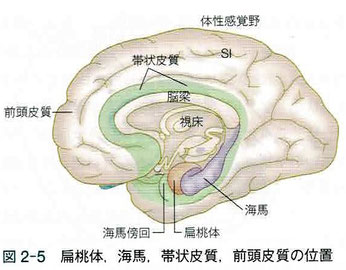
5)扁桃体:負情動形成の中心
・扁桃体は辺縁系の神経核で、不快感、恐怖、不安、怒りなど、負の情動の発現に中心的役割を担っている。
・扁桃体には、生きるうえで必要な原始的感覚(嗅覚、触覚、視覚、聴覚、味覚、内臓感覚、侵害情報など)が全て入力される。これの感覚情報に対して、過去の経験や記憶に基づいて、有害=負情動か、有益=快情動かの評価を下して記憶の固定に関わっている。
・侵害信号が入力されると、扁桃体中心核はただちに本能行動を起こすように、視床下部、脳幹網様体などの広範の領域に向けて出力を送る。その結果として呼吸・脈拍が速く顔面が蒼白になり、ストレスホルモンが分泌され、フリージングなどの情動表出も瞬時に起きる。
6)海馬支脚、嗅内皮質:不安やストレス信号を発信する
・海馬支脚腹側部は、恐怖、不安、ストレス反応に関与する神経核である。
・扁桃体、青斑核、嗅内皮質からの投射を受けて情動面に関わるほか、前頭皮質からも入力を受け、認知機能にも関与する。
・海馬支脚腹側部には、身体的ストレス回路の視床下部-下垂体-副腎皮質系(hypothalamic-pituitary-adrenal axis:HPA軸)反応を終わらせる役割がある。生体がストレスに対処する際、HPA軸が機能する。ストレスが去れば、マイナスのフィードバックがかかって、HPA軸は停止する。海馬支脚はこの停止に関わる。
・うつ病患者は、外見上はふさぎ込んで不活発そうにみえるが、脳内ではHPA軸が過剰に活動し続けており、このことによる海馬の萎縮や機能低下が考えられている。
・海馬支脚に隣接する嗅内皮質は、不安関連の痛みを増大させ、不安を覚えたときには、最悪の事態を想定して信号を発する部位である。嗅内皮質は扁桃体と密に相互連絡しており、扁桃体から不快情動を受け取り、かつ不安関連の信号を発信している。
7)帯状皮質:痛覚受容と情動に関与する
・帯状皮質は特に痛みと関係が深い。脳画像上で侵害受容応答の賦活がみられる領域は、前帯状皮質である。
・前帯状皮質は扁桃体や前部島皮質と連絡しており、海馬や視床下部からも投射を受けている。また、前頭皮質、中脳水道周囲灰白質、腹側線条体・側坐核との間にも密な線維連絡がある。
・膝周囲前帯状皮質は下行性疼痛抑制系と連絡しており、特に重要な機能を有している。また、セロトニン・トランスポーターの分布密度が、大脳皮質中で最も高い部位である。
・セロトニンは縫線核から脳の広範な神経核に送られて、不安情動の処理、睡眠や摂食機能、気分、喜びの感情などの様々な身体/精神活動に関与している。それゆえ、もし前部帯状皮質膝周囲が機能不全に陥ると、セロトニン回収が遅れ、枯渇する。そして、うつ状態や睡眠障害、自律神経の失調など、多機能に影響が起きる。
8)島皮質:自己意識の形成に関与する
・島皮質には、痛覚、味覚、嗅覚、聴覚、視覚、触覚、温度感覚などの体性感覚、胃・腸の内臓感覚や心拍など、生命機能に関わる感覚情報が入力されるが、これらの体性感覚だけでなく、怒り、喜び、恐怖、悲しみ、など情動に関する情報も入力されている。
9)前頭皮質:高次精神活動の中心
・前頭皮質は最も新しく発達した領域で、理性、思考、創造性、行動の企画、意思決定、意欲、道徳観の発達など、高次精神活動の中心となっているが、最近の研究では情動にも関与することが分かっている。
10)視床と大脳皮質体性感覚野:感覚情報の集結と修飾
・外界からの感覚情報は視床に入力され、視床を中継して大脳皮質体性感覚野へ向かう。
・視床には興奮性の中継細胞、抑制性の介在神経細胞、視床内の神経回路などがあって、感覚情報はここで様々に処理され、修飾されて大脳皮質感覚野へ向かう。
・視床は多数の核からなっており、体性感覚に関係する主要な群には、腹側基底核群、後核群、髄板内核群がある。
・大脳皮質体性感覚野は、第一次体性感覚野(SⅠ)が、頭頂葉中心後回にあり、第二次体性感覚野(SⅡ)が、その外側後方の外側溝に沿った頭頂弁蓋の内壁に位置している。
・視床と大脳皮質体性感覚野は、痛みの弁別的側面に関与しており、急性痛の情報伝達系として、非常に重要な役割を有している。
・急性痛ではfMRIによる全脳スキャンを行うと、視床の各群や体性感覚野に賦活がみられるが、慢性痛ではSⅠに賦活化はほとんど見られず、SⅡ(第二次体性感覚野)に賦活が見られるのみである。
Ⅱ 痛みを抑制する脳内機構
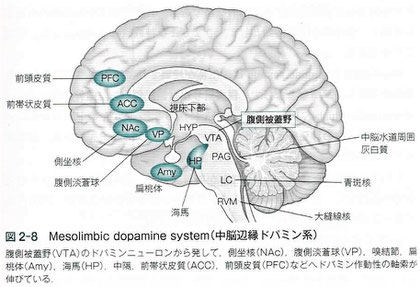
1.Mesolimbic dopamine systemと疼痛抑制機構
・生体は何千万年という時をかけて、疼痛抑制機構を発達させてきたが、その脳内機構の全体像を明らかにしたのは機能的脳画像法のおかげである。
・中脳辺縁ドパミン系は、「報酬回路」、「快の情動系」だけでなく、「痛み」の制御も操り、慢性痛への転化機序に関係している。
・「快」と「痛み」は対極のものと思えるが、脳内回路は同じである。つまり、慢性痛患者の多くは痛みに加え、快感喪失や生きる意欲を失っている可能性がある。これらの症状は中脳辺縁ドパミン系の機能低下に関連して生じる。
・中脳辺縁ドパミン系は、中脳の腹側被蓋野(VTA)のドパミンニューロンから発し、内側前脳束を経て、腹側線条体の側坐核(NAc)、腹側淡蒼球(VP)、嗅結節、扁桃体(Amy)、海馬(HP)、中隔、前帯状皮質(ACC)、前頭皮質(PFC)などへ軸索を伸ばすA10神経がある。

A10神経については”脳科学のブログ(教育への架橋)”さまに、簡潔で分かりやすい説明が出ていました。
・中脳辺縁ドパミン系は、厳密には次の2つに分かれる。
-腹側被蓋野(VTA)から、腹側線条体の側坐核(NAc)、腹側淡蒼球(VP)、扁桃体(Amy)、海馬(HP)に向かう系で、“中脳辺縁系投射”である。
-腹内側前頭皮質、眼窩前頭皮質、帯状皮質、頭皮質に向かう系で、“中脳皮質投射”と呼ばれる。
・中脳から発するドパミン投射系には、①腹側被蓋野(VTA)から発するもの、②黒質から発するもの、③後赤核領域から発するもの、の3つがある。①は中脳辺縁系投射(A10神経)で、②は黒質緻密部から背側線条体(被殻、尾状核)に向かう黒質線条体投射(A9神経)である。パーキンソン病は②の神経変性によって起きる。
・ドパミンシステムは原始的な系であるが、自律神経系や免疫系の活動とも直結し、根源的な生命活動として、様々な神経核に働きかける。
・中脳辺縁ドパミン系は、生体が侵襲されて痛みを感じた時にも機能を発揮し、鎮痛をもたらす。

画像出展:「慢性痛のサイエンス」
侵害信号が腹側被蓋野(VTA)に届くと、活動電位の群発射が起こり、VTAの軸索先端からドパミンが側坐核(NAc)に向けて放出される。NAcニューロンが興奮すると、μ-オピオイド受容体を介した神経伝達が多神経核に起きて、下行性疼痛抑制系が活性化する。
・『Dopamine & opioid systemによる痛みの制御は、進化の過程で、捕食者に襲われて怪我しながらも逃げて命を永らえさせる系として発達したと考えられている。命の危機という非常事態にあっては、上行する侵害性入力は瞬時に遮断されて、鎮痛と救命の方向に働く、脳内では前頭皮質、大脳基底核、辺縁系、中脳、橋、延髄、脊髄の神経細胞が一斉に活性化して、総がかりで命の危機に対応するのである。
このような非常事態のときばかりでなく、日常的な些細な痛みの際にもdopamine & opioid systemは機能している。包丁で指先を切ったとき、転んで膝を打ったときなど、われわれが感受する痛みは、この疼痛抑制機構のおかげでかなり軽減されているのである。』

画像出展:「慢性痛のサイエンス」
侵害信号が腹側被蓋野(VTA)に届くとVTAからドパミンが放出される。すると側坐核(NAc)のμ-オピオイド受容体が活性化し、この活性化は吻[ブン]側前帯状皮質(rACC)、背外側前頭皮質(dlPFC)、扁桃体(Amy)、中脳水道周囲灰白質(PAG)などのμ-オピオイド受容体に波及する。これが引き金になって下行性疼痛抑制系が活性化する。
・内因性オピオイドは、脳内に20種類ほど存在している。メチオニンエンケファリン、ロイシンエンケファリン、エンドルフィン、ダイノルフィンなどが代表的なものである。これらのオピオイドを含む神経核は、扁桃体、側坐核、腹側淡蒼球、視床下部、中脳水道周囲灰白質、延髄の傍巨大細胞網様核などである。
・中脳辺縁ドパミン系の中核は側坐核とみられている。これは急性痛の段階から慢性痛へ転化するか、健常な状態へ回復できるかという重要な鍵を握るのは側坐核のニューロン活動であると考えられているためである。
・側坐核は嗅結節などとともに腹側線条体の一部である。
・側坐核は情動系の前帯状皮質、扁桃体、海馬と密に連絡して快情動の発現に関与し、生きる意欲や自律神経、根源的な生命活動と関係している。しかし他方では、思考、創造、学習などの高次脳機能を担う前頭皮質とも連絡して、希望、期待、自己優越性の確立、楽観性の獲得などに関係している。
・『重要な役割を有する側坐核であるが、生体が苛酷なストレスを過剰に受けると、ニューロン活動が90日以上にわたって停止してしまうのである。NAc[側坐核]にニューロン活動停止が起きると、ドパミンシステムは機能破綻するため、ほんの些細な刺激に対しても、「痛い、痛い」と悲鳴を上げる病的な状態に陥る。同時に、生きる意欲が低下し、根源的な生命活動である睡眠、食欲、自律神経活動も障害される。このような痛みはdysfunctional pain(中枢機能障害性疼痛)と呼ばれている。』
2.下行性疼痛抑制系
・図上部のPAG(中脳水道周囲灰白質)が、rACC(吻側前帯状皮質)やAmy(扁桃体)、Hypo(視床下部)から興奮性入力を受けると、下行性疼痛抑制系が活性化し、痛み信号を脊髄後角レベルで抑制・遮断する、中脳辺縁ドパミン系が活性化すると、rACC、Amy、Hypoが興奮し、その興奮性入力がPAGに加わる。
・PAG(中脳水道周囲灰白質)は軸索を、背外側橋中脳被蓋(DLPT)と、吻側延髄腹内側部(RVM)に伸ばしており、このDLPTとRVMを介して、侵害信号の伝達を抑制している。DLPTからはノルアドレナリン作動性の抑制性投射が、RVMからはセロトニン作動性の抑制性投射が、脊髄後角(DH)に向けられ、侵害信号の伝達をDHレベルで抑制して鎮痛をもたらす。この機構が下行性疼痛抑制系である。
・下行性疼痛抑制系の研究は、1969年にラットの中脳水道周囲灰白質に留置電極を通して電気刺激すると、無麻酔で開腹手術が可能なほど鎮痛が得られることが報告された。これにより多くの研究者が下行性疼痛抑制系に関心をもち、そのメカニズムは次々に明らかになっていった。そして、機能的画像法によってヒトの脳内活動が解析されるようになって、下行性疼痛抑制系と中脳辺縁ドパミン系のつながりが明らかになった。
1)中脳水道周囲灰白質(PAG):下行性疼痛抑制系の起始核
・PAGは中脳水道を取り囲む領域で、本能行動、情動行動、自律神経機能などに深く関わっている。
・内因性オピオイドを多く含む神経核であり、下行性疼痛抑制系の起始核である。
・中脳水道周囲灰白質の神経軸索は、橋の背外側橋中脳被蓋(DLPT)と、延髄の吻側延髄腹内側部(RVM)に伸びており、この背外側橋中脳被蓋(DLPT)と、吻側延髄腹内側部(RVM)を介して、侵害信号の伝達を脊髄後角(DH)で抑制している。
2)背外側橋中脳被蓋(DLPT):ノルアドレナリン系
・背外側橋中脳被蓋(DLPT)には、青斑核(LC)が含まれる。青斑核は第4脳室底部の外側、上部橋被蓋の両側に左右1対あって、ノルアドレナリンを含んでいる。メラニン色素を含む細胞があり、第4脳室表面から青黒く透けて見える。
・青斑核はノルアドレナリン性の下行性疼痛抑制系として機能し、侵害信号を脊髄後角で抑制する。末梢組織に侵害刺激が加わると、青斑核の活動電位発射は急激に高まる。
・青斑核は下行性軸索を脊髄後角へ向かって伸ばしており、ここで放出されたノルアドレナリンが、脊髄後角細胞のアドレナリンα₂受容体と結びついて侵害信号を抑える。
3)吻側延髄腹内側部(RVM):セロトニン系
・吻側延髄腹内側部(RVM)を構成する神経核には、大縫線核、巨大細胞網様核、傍巨大細胞網様核がある。大縫線核はセロトニン系の下行性疼痛抑制系として機能し、侵害信号の伝達を脊髄後角(DH)や三叉神経脊髄路核レベルで抑制し、鎮痛をもたらす。
3.Placebo analgesiaと脳内変化
・Placebo analgesiaとは、“プラシーボ鎮痛”のことである。プラシーボ効果とは薬効成分を全く含んでいないのに、薬物と同じような効果をもたらすことである。プラシーボ鎮痛の機序根幹をなすのは、dopamine & opioid systemである。
・プラシーボ鎮痛が起きる時は、被験者の脳内でドパミン&μ-オピオイド受容体を介した神経伝達が実際に起きている。PETを用いた実験で、本物の薬剤を摂取した時と同じ変化が脳内に起きることが実証されている。
・被験者が「鎮痛効果のある薬」の作用を大きく期待した場合は、期待度が低かった場合に比べ側坐核(NAc)におけるドパミン活性が大となり、μ-オピオイド活性も増加して鎮痛効果が大きくなった。この実験で使われたのは生理食塩水であった。にもかかわらず、被験者脳内にドパミンやμ-オピオイドの代謝変動を起こしたが、脳内に劇的な変化を起こさせた鍵は、【期待すること】【希望すること】であった。
・プラシーボ鎮痛に関する一連の研究では、ヒトが期待したり予測したりすることが、いかに大きな脳内変化を惹起するかを明確に示した点で画期的であった。また、これらの研究成果は、医師への信頼、医療への期待感がもたらす治癒力の大きさを示唆している。プラシーボ鎮痛が成立するには、医師の言葉や表情、白衣、病院の建物など、期待を抱かせる根拠となる学習や記憶、認知機能が必要である。