今回のブログは『デヴィータ がんの分子生物学』という本が題材になります。日本語版の初版は2012年9月ですが、原著は2011年5月なので、今から約7年前に発行された本です。「分子生物学」とは、生命現象を分子を使って理解するという学問です。
実は、第2版の日本語版が2017年5月(原著は2015年4月)に出版されているのですが、節約のため初版ということになります。ご容赦ください。
ヴィンセント・デヴィータ氏の主な経歴は次の通りです。(ウィキペディアさまより)
●アメリカ合衆国の医師、腫瘍学におけるパイオニア。元アメリカがん協会 President。イェール大学医学大学院教授。元アメリカ国立がん研究所 director。がん化学療法における研究で知られ、1972年にはAlbert Lasker Clinical Medical Research Awardを受賞した。
●アメリカ国立がん研究所(NCI)に勤務し、1980年にはNCIおよび国家癌プログラム(National Cancer Program)のdirector に任命され、1988年まで務めた。
本の概要は下記の通りですが、これは「序」からの抜粋です。
●本書は、がんの分子生物学に関する基礎的な知識を、一冊にまとめたものである。内容構成は、がん研究に興味をもつ研究者と、がん患者の治療に大きな影響を与える基礎研究について知りたいと望む腫瘍専門医の双方に有益であろう。
●第Ⅰ部は13の章からなり、がんの分子生物学の一般的な原理をまとめ、がん細胞の挙動を理解するための基本的な仕組みが理解できるようにしてある。
●第Ⅱ部は20の個別のがんについて、分子生物学の最新知識ががんの臨床や、がん患者の管理にどのように影響を与えているかを解説した。(20とは、頭頸部がん、肺がん、食道がん、胃がん、膵がん、肝がん、大腸がん、腎がん、膀胱がん、前立腺がん、婦人科がん、乳がん、内分泌腫瘍、肉腫、皮膚悪性黒色腫、中枢神経系腫瘍、小児がん、リンパ腫、急性白血病、慢性白血病)
内容は非常に難しいものでした。ブログでは第Ⅰ部のみを対象とさせて頂き、自分なりに理解できたと思う部分のうち、ブログに残したいと感じた箇所を列挙しました。
いきなり横道に逸れてしまうのですが、がんに関する一般的な知識や情報を確認されたい場合は、下記のサイトをお勧めします。

第Ⅰ部については全体的な雰囲気をつかんでいただくために、目次をご紹介させて頂きます。
第Ⅰ部 がんの基礎知識
1.がんゲノム
1.1 がん関連遺伝子の変異
1.2 がん関連遺伝子の変異
1.3 がんゲノム解析:手法とその精度管理
1.4 がんゲノム解析によって同定されるさまざまな体細胞異常
1.5 経路にもとづくがんゲノムの解析
1.6 がんゲノムプロジェクトのネットワーク
1.7 がんゲノムの俯瞰図
1.8 がんゲノムとがんの新しい分類法
1.9 がんゲノムと薬剤耐性
1.10 がんゲノム解析の未来
2.ゲノム不安定性の機構
2.1 ゲノム不安定性に対する基本的な防御
2.2 ゲノム不安定性への抵抗機構
2.3 がんにおける変異
2.4 ヒト腫瘍におけるゲノム不安定化の機構
2.5 何が染色体不安定性と全染色体異数性の原因となるのか
2.6 全染色体異数性はがんの原因となるであろうか
2.7 がん治療への展望と示唆
3.がんのエピジェネティクス
3.1 エピジェネティックな過程
3.2 がんにおけるエピゲノムの変化
3.3 エピジェネティックな変化のタイミング
3.4 がんの早期発見のためのエピジェネティックバイオマーカー
3.5 エピジェネティック治療
3.6 エピジェネティック治療に伴う問題
4.テロメア、テロメラーゼとがん
4.1 テロメアとテロメラーゼ
4.2 細胞老化
4.3 テロメア維持とがん
5.細胞シグナル伝達、増殖因子とその受容体
5.1 シグナル伝達系
5.2 情報受容の分子装置:リガンドと受容体
5.3 プロテインキナーゼの活性調節
5.4 低分子の二次メッセンジャー
5.5 効率と特異性:多タンパク質シグナル伝達複合体の形成
5.6 シグナル伝達ネットワーク
6.細胞周期
6.1 細胞周期エンジン
6.2 細胞周期の各期への移行の仕組み
6.3 ユビキチン依存的タンパク質分解
6.4 細胞周期の制御
6.5 細胞周期とがん
6.6 マイクロRNA、細胞周期とがん
6.7 細胞周期とがん治療
7.細胞死のメカニズム
7.1 アポトーシス
7.2 オートファジー
7.3 細胞壊死
8.がんの代謝
8.1 がん細胞における代謝の変化
8.2 細胞増殖のエネルギー論
8.3 がん患者におけるがんの代謝イメージング
8.4 発がんに重要なゲノム異常が細胞代謝に及ぼす影響
8.5 代謝を標的としたがん治療
9.血管新生
9.1 序論:がんに対する血管新生阻害療法の着想
9.2 腫瘍毛細血管形成の順序
9.3 周皮細胞
9.4 腫瘍血管は機能異常を伴う
9.5 腫瘍血管新生の調整分子:血管新生の刺激因子とその受容体
9.6 腫瘍血管新生の内因性抑制因子
9.7 互いに協調的に働く腫瘍血管新生の制御因子:内皮細胞におけるNotch受容体‐DLL4シグナル経路
9.8 血管新生阻害薬の開発戦略
9.9 血管新生阻害薬を併用した化学療法やその他の治療法の効能向上
9.10 血管新生阻害薬・治療に対する耐性
9.11 腫瘍血管新生のバイオマーカーと血管新生阻害治療
9.12 血管新生阻害薬/抗VEGF薬剤にもとづいた臨床試験
9.13 先行きの見通し:血管新生阻害療法の新たな標的や薬剤、戦略
10.浸潤・転移
10.1 転移の発生と病因
10.2 転移の統合的モデル
10.3 原発腫瘍に転移能を獲得させる選択圧
10.4 造腫瘍と転移開始との関連
10.5 発がんと転移進展の関連
10.6 転移進展から肉眼的転移巣の形成へ
10.7 マイクロRNAと転移
11.がん幹細胞
11.1 腫瘍の不均一性
11.2 白血病幹細胞
11.3 固形腫瘍のがん幹細胞
11.4 がんにおける遺伝的多様性とクローン進化
11.5 がん幹細胞の起源
11.6 上皮間葉転換
11.7 がん幹細胞:標的療法
12 個別化がん治療の生物学
12.1 がんの素因
12.2 家族性腺腫性ポリポーシス
12.3 Lynch症候群
12.4 ポリポーシスがみられるその他の症候群
12.5 関連解析
12.6 乳がん
12.7 早期診断
12.8 腫瘍の分類と患者層別化
12.9 治療
12.10 チロシンキナーゼ耐性の出現
12.11 それ以外の抵抗性メカニズム
12.12 BRAF阻害薬
12.13 将来の展望
12.14 変貌しつつある個別化医療
12.15 結論
13 小分子キナーゼ阻害薬による分子標的治療
13.1 初期の成功:既知のキナーゼに変異をもつがんに標的化
13.2 PI3K経路を直接標的に
13.3 キナーゼ阻害薬の併用
13.4 がん薬物療法におけるキナーゼ阻害薬の今後の展望
ブログのポイントは次に2つです。
A.概要:がんとは何か
B.詳細:がん研究、分子生物学的キーワード
注)すべて本書の内容に基づいていますが、目次の項目をすべて網羅してはおりません。また、用語説明、補足説明など十分ではありません。
上記の2つのポイントのうち「概要」については全体から寄せ集めしたものになっています(後ろに目次名を付けています)。一方、「詳細」については目次の順番に従って、お伝えしたいと思った内容を列挙しています。また、柱となるような用語等は理解を助けてくれるようなサイトをご紹介しています。
A.概要:がんとは何か
以下の内容は寄せ集めですが、最初に全体像をお伝えするにふさわしいと思う、12.個別化がん治療の生物学の冒頭部分と「将来の展望」をご紹介させて頂きます。
●がんが遺伝子病であることはすでに十分に確立された事実である。がん細胞の遺伝子は、それが由来した正常細胞と一部異なっている。正常細胞が形質転換しがん細胞へと変化するプロセスが進行するためには、複数の遺伝子変化が必要なのである。
がんは孤発性に起こるものと、遺伝的に素因をもっている人に発生するものとに分けられる。
特定のがんを発生しやすい特定の遺伝子変異を両親から受け継ぐ人がいる。しかし、これらの人は生後すぐにがんを発症するわけではない。その細胞に、特定の遺伝子変異がさらに加わったときに、はじめてがんになるのである。
孤発性にがんを発症する人では、細胞の増殖を制御する遺伝子に体細胞変異が偶然に起きたり、または発がん物質などによって変異が起こる結果、腫瘍形成に至る一連の過程が始まるのだろう。
がんの原因になるのは遺伝子変異のみではない。遺伝子のコピー数の変化、転座、挿入、欠失、逆位などの染色体変化、遺伝子発現パターンの変化、そしてエピジェネティックな変化も、がん感受性、がん発生、がん進展に重要な役割を演じている。
それぞれの悪性腫瘍に重要な遺伝子やゲノムの変異を解明できれば、正確な診断や予後予測に役立つだけでなく、変異にもとづいて患者を層別化し、各患者に最適な治療を施せる。遺伝子やゲノムの情報にもとづいて最適な治療を選択する医療を“個別化医療”という。
がん発生、進展に重要な役割を演じる遺伝子やゲノム変化に関する情報は急速に増えつつある。がん細胞は、基本的に1つの細胞から発生したクローンである。生検、外科手術によって十分な量のがん組織を採取すれば、遺伝子やゲノムの変化を正確に検出することが可能である。その結果、がんに関する情報は他の病気に劣らず豊富に収集されている。そしてこの情報が個別化医療を進めるうえでの基礎となる。(12.個別化がん治療の生物学)
●がんの発生、進展に関与する遺伝子やゲノムの変化についての知識が積み重ねられている。そして、それらにもとづいて、適切な薬剤を選択するための知識も増えつつある。がんの遺伝子やゲノムの変化に関する研究は、高速化技術、大規模化技術により後押しされている。
遺伝子のコピー数変化、染色体の異常、遺伝子発現の変化、ゲノム規模のメチル化の変化、そしてDNA塩基配列変化を検出する技術は、ここ数年で劇的に向上した。最近のDNA塩基配列解析技術の費用の低廉化により、腫瘍やその対照となる正常細胞において多数の遺伝子、全エキソーム、さらには全ゲノム塩基配列の比較が可能となった。これにより、がんの生物学の理解が深まっただけでなく、がんの遺伝子変化と患者の遺伝情報のタイプにもとづいて治療薬を選択することが可能となりつつある。(12.13 将来の展望)
以降、目次の順に選択したものをお伝えします。
●がんは本質的に遺伝子異常に起因する疾患であり、体細胞ゲノムにおける異常の蓄積によって進展すると考えられている。(1.がんゲノム)
●がんは、臨床的に診断された時点ですでに変異DNAをもつ数十億の細胞から構成されている。(1.5 経路にもとづくがんゲノムの解析)
●ゲノム情報が明らかになる以前は、がんは基本的に2種類の情報で分類されていた。すなわち、場所(発生臓器)と外見(組織学的特徴)である。(1.8 がんゲノムとがんの新しい分類法)
●がんは、アポトーシス抵抗性、自律的増殖、細胞の不死化、細胞周期からの逸脱の回避を促進するような一連のゲノム変化から発生する。このような性質を獲得することによって、血管新生、浸潤、転移が促進される。(2.ゲノム不安定性の機構)
●ヒトの体に含まれるおよそ60兆個の細胞は、ゲノム損傷の要因に常にさらされている。通常の細胞分裂や代謝に伴う自発的な損傷と、外的な要因による損傷の両方である。細胞は、細胞代謝の副産物である酸化ストレスにさらされているが、さらに、定常的に入れ替わる細胞集団はそれに加えて、DNA複製、細胞分裂、テロメア維持の過程で起こるエラーも受ける。
細胞はまた、外部からのさまざまなゲノムに有害な作用にもさらされる。たとえば、紫外線、ガンマ線、ある種の化学物質などがある。その結果、いろいろな段階において、ゲノムが不安定になることを防ぎ、がんの促進や不利となる変異が伝搬されることを予防する機構が作られている。(2.1 ゲノム不安定性に対する基本的な防御)
●がんは、正常な細胞のホメオスタシスを制御している遺伝子が、その機能を障害されたときに起こる疾患である。(3.がんのエピジェネティクス)
●疫学研究により、エピゲノムに対する環境要因の影響が明らかにされつつあり、エピジェネティックな変化が、生活習慣要因とがん発生率・予後を結びつけるメカニズムとして寄与していることを特定した。(3.2 がんにおけるエピゲノムの変化)
●エピジェネティック異常による遺伝子不活性化は、おそらく腫瘍発生のとても早い段階に起こっている。エピジェネティックな変異は、それゆえ、発がんイニシエーターと考えられ、初期に起こる細胞のクローン性増殖につながり、さらなるがん化へのリスクとなる。また、エピジェネティックに不活性化されるという異常は、加齢、炎症などのリスク因子によって誘導されうる。(3.3 エピジェネティックな変化のタイミング)
●個体を形づくる組織の多くは、大規模な細胞の入れ替えがあって初めて機能を維持することができる。たとえば、腸管内腔を覆う上皮細胞は、週の単位で新しい細胞に置き換わり、無数の血液細胞が毎日つくり出されている。だが、個体の生涯にわたって少しずつ起こる現象は、最終的に数多くの傷害を細胞にもたらし細胞をがん化させる。
そのような傷害として、細胞増殖に伴うテロメアの持続的な短小化、DNA複製の誤り、内因的あるいは外因的な変異原による体細胞突然変異、発がん関連遺伝子の先天的な変異、エピジェネティックな遺伝子制御異常などをあげることができる。(4.テロメア、テロメラーゼとがん)
●テロメアの機能低下は、アポトーシスや細胞老化などをもたらし、重要ながん抑制機構の1つである。その一方で、p53(p53遺伝子:悪性腫瘍(癌)において最も高頻度に異常が認められている)が機能欠損した場合には、同じテロメアの機能低下が、ゲノム不安定性をもたらし、正常細胞をがん化させる動力源となるゲノムワイドな突然変異を誘導する。つまり、テロメアによるがん抑制機構は、ある条件下では、反対にがん化を促進することになる。
テロメアとテロメラーゼを基礎生物学として理解することは、それがもつがん抑制機構やがん化促進機構の理解につながる。モデル生物やヒトを用いた研究によって、テロメア機能が、ゲノム不安定性、組織や臓器のホメオスタシス、慢性疾患、老化そして発がん過程に大きな役割を果たしていることが明らかになっている。
たとえば、発がんについていうと、マウスを用いた研究から、ヒトで、加齢とともにどうしても上皮細胞に由来するがんの発生が増すのか、ある臓器に慢性炎症や変性が起こるとその臓器のがんの発生頻度がなぜ上昇するのかが明らかにされつつある。テロメアがいかに維持されるのかが基礎生物学として理解されると、その成果は、多くの種類のがんの診断と治療、老化、老化関連疾患、そして変性疾患など、テロメアが関与する臨床病態の診断や治療などに活発に応用されるだろう。(4.1 テロメアとテロメラーゼ)
●細胞老化は、テロメアとの関連にとどまらず、さまざまな発がん刺激によって活性化され、がん抑制機構として広く機能していると考えらえる。(4.2 細胞老化)
●すべてのヒト臨床がんの80%以上の症例において強いテロメラーゼ活性が確認されており、この高い陽性率は、細胞の悪性化においてテロメラーゼが果たす重要性を如実に示している。(4.3 テロメア維持とがん)
●シグナル伝達経路における変異が、さまざまな種類のがんにおいて見いだされている。(5.1 シグナル伝達系)
●細胞分裂は、完璧な正確さで遂行されなければならない過程である。1つの受精卵から成体をつくり出す過程には無数の細胞分裂が必要であり、そのたびに遺伝情報および他の大部分の細胞構成因子を正確に分配しなければならない。
細胞分裂は、限られた寿命しかもたない必須の細胞を補充するために、成体になっても引き続き行われる。そのため生物は、誤りを回避し、もし誤りが起こってもそれを修正するための、何重もの安全装置を備えた細胞分裂の仕組みを進化させてきた。
にもかかわらず誤りはある頻度で起こり、長い時間を経て蓄積された変異は安全機構を劣化させ、ゲノムを徐々に脆弱にしていく。その結果として遺伝的安定性、すなわちゲノムの安定性が失われ、がんの発生の主要な原因として生存に重要な影響を及ぼす。(6.細胞周期)
●がんは、一面では増殖が制御不能に陥る病気ととらえられる。遺伝子の変異が新たな機能の獲得や機能レベルの上昇につながり、がんに結びつく場合、その遺伝子はがん原遺伝子と呼ばれる。
がん原遺伝子は、通常増殖や分裂を促進するタンパク質をコードしている。機能を喪失するような変異ががんを引き起こすような遺伝子は、がん抑制遺伝子と呼ばれる。がん抑制遺伝子は、通常増殖や分裂を負に制御し、細胞ががん化するのを防ぐ因子をコードしている。(6.5 細胞周期とがん)
●オートファジーの機能は、ストレスを受けた組織と腫瘍において特に重要である。なぜなら、このような組織や腫瘍においては、効率的でない好気性解糖系に依存していたり、急速な腫瘍の成長や転移の間に血液供給が断続的で限られていたりすることにより、代謝性のストレスに定期的にさらされているからである。それゆえ、組織や腫瘍のオートファジー欠損は、細胞の適応状態を減少させ、細胞を、DNA障害、変異、ゲノム不安定性を受けがちな状態にし、そしてそのことが腫瘍の開始と進行に寄与する。
これらの細胞自律的な機構に加えて、オートファジー欠損は、腫瘍内で慢性的な細胞死や炎症を起こす細胞の生存率を下げることによって、腫瘍形成を細胞非自律的に促進する。(7.2.1 代謝ストレスに対する細胞の生き残りを促進するオートファジーの役割)
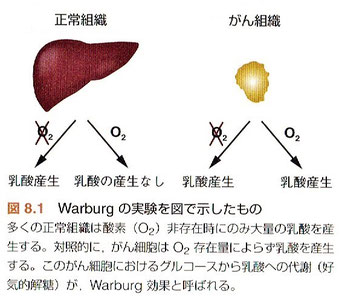
●がん組織は正常組織と異なり酸素の有無によらず大量の乳酸を産生する(好気的解糖)。そして、この代謝の特徴はがんの診断に活用され、また初期の化学療法の開発へとつながった。しかし、細胞の代謝の違いを応用したがん治療法はまだ少ない。がん代謝の研究は現在活発な研究分野であり、がん治療における新規標的を含んでいると期待されている。(8.がんの代謝)
※好気的解糖(ワークブルク効果)
こちらは「健康用語WEB事典」さまのサイトの一部です。

正常細胞は酸化的リン酸化によってエネルギーを得ているのに対し、がん細胞は酸化的リン酸化ではなく好気的解糖によってエネルギーを得ています。酸化的リン酸化と比較してグルコースからATPを産出する能力が著しく低下するにも関わらず、がん細胞は好気的解糖をひたすら行っているのです。この現象をワールブルグ効果(the Warburg effect)と呼びます。
※がん細胞のエネルギー代謝
こちらは「KOMPAS」という慶應義塾大学病院さまの 医療・健康情報サイトの内容の一部です。

がん細胞は自身が増殖するために正常細胞とは異なるエネルギー利用戦略をとります(図1)。まず、通常正常細胞は酸素が十分にある環境下では、取り込んだブドウ糖をミトコンドリアにて酸化的リン酸化を通じて、エネルギー通貨であるアデノシン三リン酸(ATP)を作ります。それに対し、がん細胞は、酸素の有無にかかわらず、ブドウ糖の細胞内への取り込み量を増やすと同時に、取り込んだブドウ糖を乳酸に代謝する「解糖系」という代謝経路を活性化することでATPを得ています。この現象は発見者の名前に因み、「ワールブルグ効果」と呼ばれています。もうひとつ重要な点は、がん細胞は他の細胞種に比べ、高いストレス耐性を身につけているということです。このようながん細胞の特徴が抗がん剤による化学療法、放射線治療などのがん治療の分野で問題になっています。
●ヒトのがんは細胞の不適切な増殖を促進するようなゲノムとエピゲノムの異常の結果として発生する。これらイベントは腫瘍の形成や進展にかかわるがん遺伝子の活性化やがん抑制遺伝子の不活性化を引き起こす。
特定のがん遺伝子やがん抑制遺伝子の変化はある種の特異的な悪性形質における特徴となっているが、このような遺伝子の変化の多くがさまざまながん種から発見されている。これらの遺伝子変化はさまざまな細胞シグナル伝達経路や転写経路等に存在しているが、これらいくつかの変異が協同して不適切な細胞増殖を起こしているのかはよくわかっていない。
これら遺伝的変化がもたらす1つの共通した結果は細胞代謝の変化である。(8.4 発がんに重要なゲノム異常が細胞代謝に及ぼす影響)
●腫瘍において変化している細胞内代謝の生物学的役割として最も強調しておくべきことは、がんを促進する多数のゲノム異常の共通の結果として、グルコースの摂取および代謝が亢進しているということである。すなわち、形質転換はグルコース摂取の亢進と連動している。(8.4 発がんに重要なゲノム異常が細胞代謝に及ぼす影響)
●がんにおける代謝調節のメカニズムとその調整機構が、がん細胞の生存に不可欠とされている遺伝子変異により左右されるという事実は、がんがこういった代謝に依存しており、その点をがん治療に利用できる可能性のあることを示唆している。
事実、最初に効果を上げた化学療法の1つは葉酸代謝が標的である。葉酸が血球細胞の増殖を促進させるという発見は最終的に化学療法剤としての抗葉酸剤の開発をもたらした。また、プリン代謝を標的とした化学療法剤も使われている。
これらの薬剤は現在では細胞傷害性のがん治療薬であると考えられているものの、腫瘍細胞の代謝依存性を標的とすることにより最新のがん治療においても重要な役割を果たし続けている。(代謝を標的としたがん治療)
●腫瘍血管新生を標的にした有望な戦略が数多く存在するといえる。これらの戦略から途方もない数のさまざまな血管新生阻害薬が発見されるに至った。これまで認可された血管新生阻害薬はすべてVEGFか受容体チロシンキナーゼVEGFRを標的にしたものである。(9.8 血管新生阻害薬の開発戦略)
●15年前(現在2018年から22年位前)に仮説が立てられた血管新生阻害によるがん治療の理論上の利点は、この治療の理論上の利点は、この治療法なら薬剤耐性が獲得されて薬の効き目が時間を経るごとに薄れていく恐れが少ないだろうということであった。しかし、前臨床実験でも臨床においても、血管新生阻害薬を投与すると、他の抗がん剤や治療法と同様に耐性獲得の問題が深刻であることが示されている。(9.10 血管新生阻害薬・治療に対する耐性)
●がんは過形成から発生し、しだいに形態異常や浸潤能を獲得した腫瘍となり、やがて遠隔の臓器へ無作為でない方式で転移していくことを病理学者は長年にわたって観察してきた。このような、発生の源の臓器から遠隔の組織へがんが広がることを転移と呼ぶ。
近年、細胞の増殖、細胞死、ゲノムの不安定性、シグナル伝達機構に関する研究は急速に進展してきたが、それでも転移の分子メカニズムに関する詳細な理解はまだかなり遅れているといえる。(10.浸潤・転移)
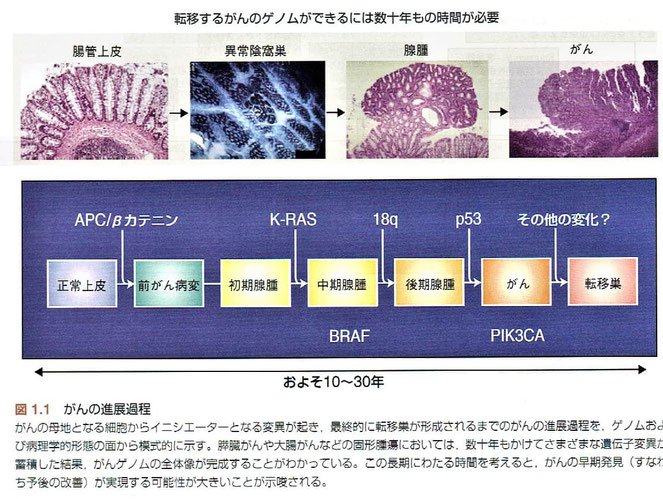
●過形成および異形成の病変が必ずしもがんへ進展するわけではないが、これらの病変ががんへ進行するときには、数十年ではないにしても数年の歳月を要する。
このような悪性腫瘍がゆっくりと生じていくという特徴は、がんの発症率が年齢に依存して増加するという疫学研究の結果と合致する。転移はしばしば種々の臨床的かつ病理学的な特徴と関連している。このうち、腫瘤の大きさと所属リンパ節への浸潤は、遠隔転移による再発とよく相関している。腫瘤の大きさに関しては明確な閾値はないが、傾向は明らかである。たとえば、乳がんの転移のリスクは2cm以上で急激に増加する。一方、肉腫の遠隔転移は腫瘍の大きさが5cm以上の場合に、より一般的にみられる。所属リンパ節への転移は常ではないが、しばしば遠隔転移のリスクが高い前兆である。
1.腫瘍の悪性度(グレード)
・分化の程度が低いか、あるいは対応する正常組織の特徴をほとんど保持していない腫瘍は、一般に高悪性度とされる。
2.正常組織の区画の境界を越えた浸潤深度
・メラノーマ(悪性黒色腫)や消化管腫瘍では、基底膜を越えてどの程度深部まで浸潤しているかでステージ分類を行う。
3.血管・リンパ管への浸潤
・血管やリンパ管に腫瘍栓子がみられる場合は、これがみられない場合に比べ一般に予後が悪い。例として、乳がんや、頭頚部や子宮頸がんの扁平上皮がんがある。 (10.1 転移の発生と病因)
●転移における重要なステップの1つは、血管外遊出ののち、遠隔部位で増殖を続ける能力を獲得することである。乳がんや前立腺がんなど多くのがんは、原発腫瘍を切除したのち数年から、ときには数十年たっても、転移を起こさない。こうした潜在性のものを転移休眠状態と呼ばれ、肉眼的転移が形成される前に存在する障害とされている。(10.6.1 休眠状態)
※乳がんのかくも長き休眠の仕組み解明
こちらは科学技術振興機構さまが運営されている「サイエンスポータル」という科学技術の最新情報を提供する総合WEBサイトに出てきた記事です。
●がん研究の主要な焦点は、腫瘍の開始と進展の根底にある分子の変化の解明である。腫瘍は多段階のプロセスであり、十分に遺伝的またはエピジェネティックな変化が蓄積された結果、形質転換して幹細胞のプログラムをもつようになった細胞ががん幹細胞であると考えることができる。しかし、そのような変化がいつ、そしてどのような順序で発生するかについてはほとんどわかっていない。“がん幹細胞”に“幹”という語があるために、がん幹細胞は常に幹細胞から生じるという誤解が頻繁に生じている。逆に、近年の知見により、正常な幹細胞に由来するがんもあるかもしれないが、分化した前駆細胞が形質転換の標的となりうることが示唆されている。(11.5 がん幹細胞の起源)
●特定のがんを発症しやすい家系がある。がんを発症した患者(特に若年で発症した患者)の子や孫は、がんの発症率が高いことが疫学的に知られている。がんの素因が遺伝することは、家系解析、双生児研究からも示されている。がんの素因がある家系で発生する悪性腫瘍に、小児網膜芽細胞腫、大腸がん、若年性乳がん、腎がんなどさまざまなものがあるが、最もよく研究されているのは大腸がんを発症する家系である。(12.1 がんの素因)
B.詳細:がん研究、分子生物学的キーワード
目次の順になっています。また、補足等のために他のサイトをご紹介しています。
第Ⅰ部
1.がんゲノム
●「転移するがんのゲノムができるには数十年もの時間が必要」この長い時間を考えると、がんの早期発見が実現する可能性は大きいと考えられる。
※ゲノム
ゲノム(Genom)とは、遺伝子(gene)と染色体(chromosome)から合成された言葉で、DNAのすべての遺伝情報のことです。
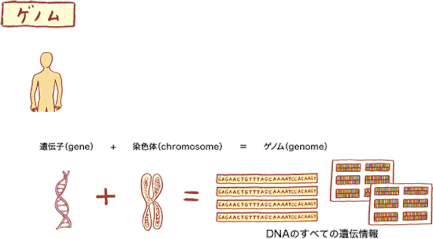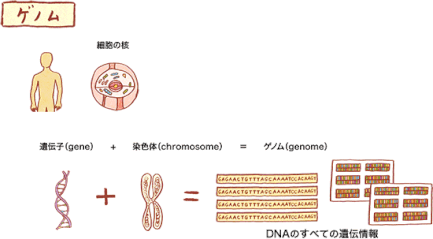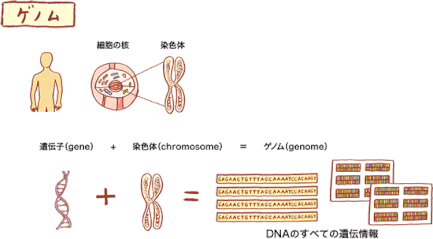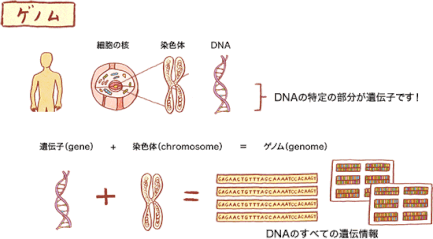
DNAについては『DNAは、はしごをひねったような形をしていて、核の中の染色体の中に折りたたまれて入っています。DNAを簡単に言うと、私たちの体を作る設計図と言えます。』との説明がされています。
1.1 がん関連遺伝子の変異
●“がん遺伝子”と“がん抑制遺伝子”に分けることができる。
●がん遺伝子の変異箇所は多くの場合、特定のコドンあるいはその周囲といった“ホットスポット”に集中する。
※コドン
遺伝暗号の単位。遺伝情報を担う伝令RNAを構成する4種の塩基配列で、連続する三つの塩基が一組となったもの。

こちらのサイトに「コドン」に関する詳しい説明が出ていました。
・塩基3つの暗号を「コドン」といい、コドンの並び順によってアミノ酸の結合順序が決定されます。
・コドンによって指定されたアミノ酸が、コドンの並び順にしたがってつなげられていくというわけです。
・簡単に言えば、全部で64個あるコドンという単語で書かれた文が遺伝子なのです。
1.2 がん関連遺伝子の同定
●2004年にヒトゲノムプロジェクトが完成して、正常ヒトゲノム地図が作成された。
●正常ゲノム構造の多型も明らかになり、かつては不可能だったがん細胞における体細胞変異のリストが高速で作成されつつある。これらを用いたアプローチによってヒトがんにおける遺伝子異常のすべてを同定することが可能になった。

こちらは、「浜島書店生物図表Web」さまに出ていた『ヒトゲノムマップはこうしてつくられた』という記事です。
これによると、ヒトゲノム計画の目的は、ヒトのDNAの全塩基配列を解読することである。ということです。
1.3 がんゲノム解析:手法と精度管理
これを見ると、次のようなことが確認できます。
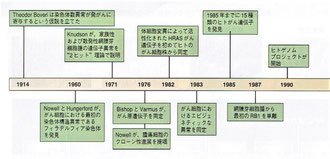
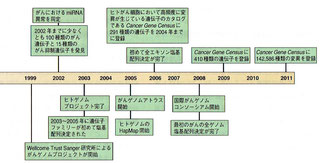
1985年:1985年までに15種類のヒトがん遺伝子を発見
1990年:ヒトゲノムプロジェクトが開始
2002年:2002年までに少なくとも100種類のがん遺伝子と15種類のがん抑制遺伝子を発見
2011年:Cancer Gene Censusに142,586種類の変異を登録
画像出展:「デヴィータ がんの分子生物学」
●最初に行われたのは、タンパク質および脂質のリン酸化にかかわる遺伝子群だった。
●大腸がんの50%においてチロシンキナーゼかチロシンホスファターゼ、あるいはその両者の変異が存在することになり、タンパク質のリン酸化システムが発がんに重要な役割を果たすことが再確認された。
●PIK3CAはKRASと並んで、ヒトがんで最も高頻度に変異が認められる遺伝子といえる。
●がんにおける遺伝子ファミリー解析の多くはキナーゼ全体に対して行われてきたが、最近の解析結果では、他のファミリー遺伝子群もがんにおいてしばしば変異が生じていることが明らかになった。その1例としてタンパク質分解酵素(プロテアーゼ)が上げられる。プロテアーゼは少なくとも569種類の遺伝子からなる複雑な酵素グループである。
●酵素群は広範囲な基質を分解できることが明らかになり、発がんの初期だけでなく、さまざまなステップで影響を及ぼすことが示された。
●プロテアーゼ遺伝子群は、当初の転移誘導遺伝子という概念を超えて、がん抑制遺伝子として働くことも多いことが確認され、がんに対して2種類の役割を果たすことが明らかになった。
●がんに関連することが以前は知られていなかった数多くの遺伝子が発がんに関与することが明らかになった。
●解析で得られる膨大なデータを解析するためには、新しい統計手法およびバイオインフォマティクス手法を開発することがきわめて重要である。
※がんゲノム医療
こちらは「木沢記念病院」さまのサイトです。

『「がん」は様々な遺伝子の異常が積み重なることで発症し、その遺伝子の異常は個々の患者さんごとに異なることが近年の研究により判ってきました。
がんゲノム医療とは、一人ひとりのがんの個性(原因)を明らかにし、患者さんにより適した治療薬の情報をご提供する次世代のがん治療です。 遺伝子レベルでご自身のがんを知ることは、治療薬などの治療方針の選択に役立ち、副作用の軽減や病状の緩和などが期待できます。』
こちらは富士通総研さまのサイトです。
「動き出したがんゲノム先進医療と今後の展開、ビジネス展望について」というタイトルです。

『2018年4月より、国内でがん治療における患者のゲノム情報に応じた抗がん剤治療を行う先進医療が始まりました。本稿では、がん治療における「ゲノム先進医療」をキーワードとして取り上げ、今後のがんゲノム先進医療の方向性、ゲノム情報の二次利用とそれに伴う課題、解決の方向性、および今後の動向に対するビジネス視点での展望について述べます。』
※バイオインフォマティクス(生命情報科学)
『生命科学と情報科学の融合分野のひとつで、DNAやRNA、タンパク質の構造などの生命が持っている「情報」といえるものを情報科学や統計学などのアルゴリズムを用いて分析することで生命について解き明かしていく学問である。機械学習による遺伝子領域予測や、タンパク質構造予測、次世代シーケンサーを利用したゲノム解析など、大きな計算能力を要求される課題が多く存在するため、スーパーコンピュータの重要な応用領域の一つとして認識されている。』(ウィキペディアさまより)
1.4 がんゲノム解析によって同定されるさまざまな体細胞異常
●がんの全ゲノム配列解析を行うと、悪性腫瘍にみられるほとんどの体細胞変異を検出可能なはずである。それによって発見できる体細胞変異は多彩で、一塩基置換、小さな挿入・欠失、大規模な染色体の再構成、さらに染色体のコピー数異常などがある。
●ゲノムの塩基置換(DNA分子の塩基が、複製の間違いや修飾により他の塩基に変わる現象)はがん細胞において最も高頻度に見つかる体細胞変異であるが、その頻度はがん種によって大きく異なることがわかっている。
1.6 がんゲノムプロジェクトのネットワーク
下の図は、「がんゲノム解析の全体像」と題されたものです。

キーワードは、塩基置換パターン、変異率、メチル化、RNA発現、パスウェイ解析、染色体再構成、染色体コピー数異常、遺伝子変異プロファイルの8つが上げられています。
画像出展:「デヴィータ がんの分子生物学」
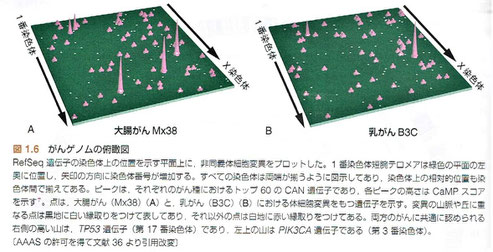
1.7 がんゲノムの俯瞰図
●がんゲノムにおける変異が網羅的に解析された結果、新たながんゲノムの俯瞰図がもたらされた。そこでは、高頻度に変異が生じるわずかな遺伝子からなる変異山脈と、低頻度にしか変異が生じない大多数の遺伝子からなる変異の丘があるのだ。がんゲノム俯瞰図を見て最も興味深い点の1つは、がん種ごとに異なった遺伝子セットの変異が存在することである。俯瞰図のたとえでいえば、大腸がん、肺がん、乳がんのそれぞれで見ることのできる風景はまったく違っているということになる。したがって、変異を受ける遺伝子の多くは胎生期および成人のさまざまな組織で発現しているが、特定の遺伝子の変異は特異的な臓器、発達段階、分化レベル、がん化ステップで生じやすいということになる。さらに、異なったタイプのがんは、それぞれ特定のセットの遺伝子変異を蓄積しやすいともいえる。たとえば、消化器以外のどのようながんも、大腸がんにおける典型的な変異遺伝子セットの蓄積をもつことはない。
1.9 がんゲノムと薬剤耐性
●単剤による分子標的治療法は、ほとんどすべての例で薬剤の耐性獲得を生じることになるが、この薬剤耐性メカニズムを解明するうえでもゲノム解析はきわめて有用である。
1.10 がんゲノム解析の未来
●がんゲノムの俯瞰図はまだ決して完全ではなく、これまでの研究結果は新たな、かつ、重要な疑問を提起したにすぎないともいえる。また、体細胞変異検出法の技術的側面についても、さらなる改良が必要である。
●各種の腫瘍におけるがんゲノムファイルを明らかにすることも、今後の重要なテーマである。
●これまで同定さてきた数百ものゲノム異常が細胞に対してどのような影響を及ぼしているかも解明する必要がある。
●結論として、がんゲノム解析の到達目標は、がんを分子レベルでよりよく理解するだけでなく、新たな診断法・治療法をも開発することにある。
2.1 ゲノム不安定性に対する基本的な防御
●多くの細胞は、ゲノムに害をもたらす損傷から自らを守ることができる生理的な特性ももっている。たとえば、皮膚のメラニンは紫外線を吸収する。また、抗酸化物質、あるいはカタラーゼやスーパーオキシドジスムターゼのような酵素は、細胞代謝の結果産生される活性酸素種の濃度を低下させる。
3.がんのエピジェネティクス
●ヒトのがん化に果たす遺伝子変異の重要な役割が、この数十年で同定されてきた。最近では、遺伝子的な変化に加えて、エピジェネティックな過程の重要性が認識されるようになった。
※エピジェネティクス
こちらはテルモ生命科学芸術財団さまが運営されている[中高生と“いのちの不思議”を考える―生命科学DOKIDOKI研究室]というサイトです。

ここに『がんの研究などにも重要な意味をもつ「エピジェネティクス」』という会話形式の説明書きがありました。なお、以下はその中の一部です。
『私たちのからだは、精子と卵子でつくられる受精卵が分化して、眼や腕や心臓などの細胞が形づくられていて、どんな細胞をつくるかは遺伝子によって決まります。どの細胞も基本的には同じ遺伝情報を持っているのに、それぞれ別々の細胞になるのはなぜか。それはそれぞれの細胞で使われる遺伝子と使われない遺伝子が決まっているからです。そして、それぞれの細胞には、使われる遺伝子と使われない遺伝子に、ある種の目印がついています。これが「エピジェネティクス制御」です。』
3.1 エピジェネティックな過程
●ほぼすべてのがんには、多数の体細胞変異だけでなく、遺伝子と協働してがん表現型を形づくるエピジェネティックな異常が存在する。エピジェネティックな異常は、遺伝子変異に先立って、発がん過程の早期に起こるので、早期発見における検索標的となる。エピジェネティックな変異は、薬物治療によりもとに戻る可能性があり、エピジェネティクス治療の有効性を期待させる。
●最近の研究の進歩により、全ゲノムについてエピジェネティックな情報(エピゲノム)を分析することが可能になってきた。それにより、発生過程に起こるエピゲノムの変化の多彩さや、エピゲノムが調節経路の活性化・不活性化に果たす役割を解明できるようになってきた。
※エピゲノム
こちらは国際ヒトエピゲノムコンソーシアム (IHEC:通称アイヘック)の日本チームさまが運営されているサイトです。ここに『国立がん研究センター研究所の服部奈緒子研究員に聞きました!なぜ今、エピゲノムなんですか? エピゲノムって、なんですか?』というQA形式の説明がありました。なお、以下はその中の一部です。
Q:「ゲノム」とは生きものがもつDNAの塩基配列の情報全てと聞きました。「エピゲノム」は耳慣れない言葉ですが、ゲノムとエピゲノムは何がちがうのですか?
A: DNAの塩基配列を変えることなく、遺伝子のはたらきを決めるしくみをエピジェネティクスとよび、その情報の集まりがエピゲノムです。
こんな風にイメージしてください。ゲノムをA,C,G,Tの4種類の音符が並んだ音の羅列だとすると、音に強弱をつけたりテンポを変えたりして曲を奏でるしくみが、エピジェネティクスです。私たちの身体をつくる細胞には、基本的にすべて同じゲノムが入っているのに、いろいろな種類の細胞になれています。これは、同じ音の羅列(DNA の塩基配列)をつかって、ちがう曲(皮膚の細胞や腸の細胞などおよそ200種類の細胞)を奏でるしくみ、つまりエピジェネティクスのおかげなのです。
3.2 がんにおけるエピゲノムの変化
●エピゲノムの変化は、自らを強めていく進行性の特徴をもち、がんの最も強いリスク因子の1つである加齢のような、正常の細胞過程においても生じる。
●ゲノムの恒常性を制御する重要な遺伝子など、いくつかの要素(たとえば、がん抑制遺伝子、細胞接着、細胞分裂の制御、アポトーシス経路の遂行)はみな、がん細胞では不適切にエピジェネティックな不活性化を受けている。
●がんエピジェネティクスの研究は、30年以上前に、正常細胞に比べてがん細胞ではDNAメチル化の状態が大きく変化しているという観察により始まった。
●がんエピジェネティクスの研究分野は、がんで起こっているエピゲノムレベルの変化を全体的に観察し、これらの調節異常がどのようにがんの病態に寄与しているかの理解へと進んでいる。
※細胞接着
多細胞生物は細胞同士が接着している。動物細胞の細胞接着には、密着結合、接着結合、デスモソームによる結合、ギャップ結合などがある。細胞が互いに認識・結合し、組織や器官を形成し、これらが集まり合うことで多細胞生物の個体が形作られる。
3.5 エピジェネティック治療
●エピジェネティックな変化が広くみられること、特にがんにおいてDNAメチル化異常が生じていることは、これらのエピジェネティックな変異をもとに戻し、がん細胞に、正常な遺伝子発現パターンを回復させるような薬剤の開発を促した。エピジェネティックな変化が腫瘍発生の早期に観察されるという事実により、この過程は化学的予防の魅力的な標的となっている。現在、4つの薬剤が、米国食品医薬局(FDA)により血液悪性腫瘍の治療に対して承認されている。
3.6 エピジェネティクス治療に伴う問題
●エピジェネティック治療の臨床的効果は、ランダム化試験で認められているが、がん治療に広く適用するには問題が残る。1つの問題点として、エピジェネティックな過程を阻害する薬剤が相対的に非特異的であることである。
●エピジェネティック治療のもう1つの問題として、正常細胞への影響の可能性と、正常細胞における通常のエピジェネティックな過程への副次的な障害を及ぼし、異所性の遺伝子活性化をもたらしてしまうことがある。
4.テロメア、テロメラーゼとがん
●増殖を続ける細胞は、日ごろ、がん化をもたらしかねない体細胞突然変異を繰り返し起こしながら、どのようにしてがん化を防いでいるのであろうか?
正常細胞ががん化につながりかねない突然変異を実際に起こしていることは、たとえば、新生児臍帯血を調べると、その約1%の例で、AML1-ETO融合タンパク質などの急性白血病発症にかかわる融合遺伝子を示す白血球細胞クローンをもつことが報告されており、また、正常成人のおよそ1/3では、濾胞性リンパ腫発症にかかわるIgH-BCL2遺伝子融合を示すリンパ球が検出されるという報告からも明らかである。急性白血病や濾胞性リンパ腫の罹患率は、以上のような異常な突然変異が正常人で検出される頻度よりもはるかに少ないので、たとえ、がん化を促進する遺伝子異常正常細胞に生じたとしても、がん抑制機構が強力に機能して実際にがん化することを防いでいることがわかる。
●がん抑制機構が活性化されると、最も特徴的な現象として、アポトーシス(細胞死の1つ)と細胞老化(非可逆的増殖停止)が誘導される。これらは、p16INK4a-Rb経路、ARF-p53経路および染色体末端にあるテロメアなどを介したチェックポイント機構によってもたらされる。遺伝的にプログラムされたこれらの経路が協力してがん抑制機構として機能し、その結果、将来、がん細胞になりかねないような細胞を生体から除いたり、増殖を制限して数が増えすぎないようにしている。
●本章では、テロメア機能がどのように変化し、その結果誘導されるチェックポイント、特に、細胞老化が細胞の腫瘍化をいかに防いでいるかについて論じる。
数多くの臨床医学あるいはトランスレーショナル研究の成果から、テロメアと細胞老化がそのような細胞増殖制御をもたらすことが明らかになっている。さらに、近年急速に進展しつつある臨床研究から、テロメアと細胞老化が、がんをはじめとするヒトのさまざまな疾病に関係があることが明らかにされつつあることを論じる。
4.1 テロメアとテロメラーゼ
●テロメアは、線状DNAからなる染色体の両末端に位置する特殊なDNA・タンパク質の複合体であり、脊椎動物では3つの部分からなる。
●MullerやMcClintockが1930年代に行った研究から、テロメアの基本的な役割は染色体末端キャップ(保護)し、末端どうしが融合することを防いで染色体の安定性を保証することにあることがわかっている。その後の研究から、このようなテロメアの役割は、動物界、植物界にわたって共通であることが示され、テロメア複合体が生物にとってなくてはならない役割を果たしていることがわかる。
※テロメラーゼ
こちらは「テロメア最先端医療医学学会」さまのサイトに書かれていた内容の一部です。

『"テロメラーゼ"は、真核生物の染色体末端に存在するテロメアの特異的反復配列を伸長させる酵素です。しかし、ヒトにおいては、生殖細胞・幹細胞・ガン細胞などでの活性が認められており、それ以外のテロメラーゼ活性はほとんど見られません。したがって、活性を高めることで「細胞分裂寿命の延長」、活性を抑制することで「ガン治療」といった両面で注目を浴びています。』
※テロメア、テロメラーゼと細胞老死と細胞死
こちらは「メルク」さまのサイトに書かれていた記事の一部です。

『テロメラーゼは特殊なリボ核タンパク質で、テロメラーゼ逆転写酵素(TERT)、内在性RNA鋳型(TR)、および数種の関連タンパク質からなります。主な機能はテロメアの安定化で、これにより染色体の組み換えと末端間融合(end-to-end fusion)が防止されます。テロメアはDNA損傷を認識し、細胞の複製能を制御します。細胞分裂のたびに、DNAの一部が染色体の末端から失われます。これは、従来型のDNAポリメラーゼでは、直線状DNA分子のラギング鎖の3'末端の完全複製が不可能なためです。』
4.2 細胞老化
●ヒト初代培養細胞は、たとえ、適当な培養環境下で培養されたとしても、テロメアがある閾値まで短小化すると、それ以上の分裂ができなくなる分裂能の限界を迎える。その状態を細胞老化と呼ぶ。
●テロメアの短小化とそれに伴うテロメア脱保護に加えて、細胞老化は、ある種のDNA損傷、酸化ストレス、細胞増殖に適切でない環境、ある種のがん遺伝子の活性化などによってもたらされる。
●細胞老化が生体内でがんの発生を予防する重要な役割を果たしていることが、いくつかの独立した証拠から明らかになっている。しかし、生体で細胞老化が起きていることを示す明瞭なバイオマーカーが発見されていないため、この分野の研究には限界があることも理解する必要がある。
●がん細胞が「腫瘍を維持する」ためには、がん遺伝子を持続して活性化する必要があることはすでによく知られているが、細胞老化チェックポイントが常に不活性化されていることが、それと同じくらいに腫瘍の維持に必要であることが明らかにされつつある。
4.3 テロメア維持とがん
●加齢に伴ってがん化に貢献する遺伝子変異が蓄積したり、環境に存在する発がん物質や酸化損傷などによってDNA損傷が加速度的に生じることでテロメアチェックポイント(DNA傷害チェックポイント)反応が失活したり、テロメアの短小化速度が亢進し、前がん状態にある細胞をクライシス状態にある細胞集団のなかから、ほんの一部の細胞のみが多くの場合テロメラーゼの再活性化を伴って、生存・増殖が可能となり、悪性細胞として広がる。したがって、テロメア短小化は、チェックポイント機構が万全である限りにおいてがん抑制機構として機能するが、チェックポイント機構が不活性化された場合には、がん細胞が新しく生まれるために必要な多数の遺伝子変異の蓄積を促進するのである。
●最近のいくつかの研究によって、テロメア機能異常がもたらす発がん促進効果は、ヒトにおいて、がんへの罹患しやすさを決定する1つであることが示されている。
●これまでのヒトゲノム解析によって、5番染色体5q15.33にある多型配列が皮膚、肺、膀胱、前立腺、子宮頸がんなどのさまざまな組織由来のがん発症率と関連があることが知られている。
●比較ゲノムハイブリダイゼーション法を用いた研究により、乳腺、食道、大腸の異型性病変では、染色体のさまざまな領域の付加および欠失が、病初期の段階、しばしば、上皮内がんや浸潤がんを呈する病期よりもずっと以前に認められることが明らかとなった。
●テロメラーゼによるテロメア維持反応を標的とする阻害薬は、安全性や臨床効果は十分に明らかになっていない。現在、テロメラーゼに関連したがん治療法で臨床試験が進んでいるのは、免疫療法、すなわち、テロメラーゼが発現している細胞を免疫細胞が確認して殺す方法である。細胞傷害性T細胞が引き起こす反応を、hTERTタンパク質のペプチド断片を使って誘導することができ、そのようなT細胞は細胞表面に主要組織適合性複合体クラスⅠ分子とともにTERTペプチドを発現している細胞を選択的に溶解することが証明されている。
●テロメア生物学は近年急速に発展し、その成果を、がんをはじめとするさまざまな疾病の新しい診断法や治療法の開発の応用する時期にきている。2009年のノーベル賞が授与されたテロメラーゼの発見をはじめとして、テロメア生物学の数々の成果は、ヒトのがんや遺伝性あるいは獲得性の変性疾患の理解に多大な貢献をしている。テロメラーゼ欠損マウスの研究で初めて明らかとなったように、上皮由来のがん細胞においてテロメア機能不全によるゲノムの不安定性が一過的に起こることは、いまや、さまざまな種類の臨床がんを用いた研究によって確かめられ、さらに先天的なテロメア機能異常症をもつ家系のゲノム解析からも支持されている。テロメアの短小化が発がんや組織の老化に果たす役割の重要性から、テロメア短小化を利用したがんになるリスクを予測するバイオマーカー、診断技術、合理的な治療法の開発ができるようになると期待される。
※比較ゲノムハイブリダイゼーション
比較ゲノムハイブリダイゼーション(CGH)または染色体マイクロアレイ解析(CMA)は分子細胞遺伝学的手法の1つであり、試料のDNAのコピー数変化(過剰/減少)を解析する。腫瘍細胞を解析することが多い。(ウィキペディアさまより)
5.細胞シグナル伝達、増殖因子とその受容体
5.1 シグナル伝達系
●シグナル伝達は細胞レベルでのコミュニケーションを可能にする化学反応である。
●細胞は細胞外および細胞内環境からのシグナル、あるいは他細胞からの直接のシグナルを検知する。これらのシグナルに対して細胞はさまざまな手段で、主としてタンパク質の発現量、活性および局在を変えることにより応答する。タンパク質の発現量は転写・翻訳・分解の速度により調節され、タンパク質の活性は共有結合性修飾や、他のタンパク質あるいは低分子化合物との非共有結合性の相互作用によって影響される。成熟した生物においても、発生途上の生物においても、シグナル伝達経路により、分化、細胞分裂、細胞死が調節される。
5.2 情報受容の分子装置:リガンドと受容体
●シグナル伝達経路は、とてつもないバラエティに富む刺激に応答するように発達してきた。シグナル伝達の一連の反応を開始する分子としては、タンパク質、アミノ酸、脂質、ヌクレオチド、気体分子、光などがある。ほとんどの細胞外シグナル伝達分子は、細胞増殖因子のように細胞膜上の受容体に結合するが、アンドロゲンやエストロゲンのように細胞内に拡散し、細胞質や核内の受容体に結合するものもある。シグナルは、細胞外マトリックスにより発せられるもののように持続的なものもあれば、血糖値の上昇に応答した膵β細胞によるインスリン分泌のように一時的なものもある。シグナル伝達分子がどこに由来するかは、さまざまである。神経伝達物質などのように細胞内に貯蔵されており、他の細胞とコミュニケーションをとるために特定の条件下で放出されるものもある。その他、細胞外に貯蔵され(たとえば、細胞外マトリックス中に)、組織の損傷や再構築に際して使われるものもある。伝統的に、シグナルは由来する細胞にもとづき、遠隔の細胞に影響するもの(内分泌、endocrine)、近傍の細胞に影響するもの(傍分泌、paracrine)、同一の細胞に影響するもの(自己分泌、autocrine)に分類される。細胞は内からのシグナルにも応答する。重要な例として、細胞周期が正しい順序で進行するように保証するチェックポイント経路や、損傷DNAを感知して修復する経路がある。
●細胞内シグナル伝達を開始するさまざまな受容体やリガンドの構造や作用メカニズムは異なっていても、ほとんどの受容体はシグナル伝達にあたり、共通の下流分子のセットを活性化する。シグナル伝達分子としてはプロテインキナーゼ、脂質キナーゼ、Gタンパク質、ホスホリパーゼ、プロテアーゼ、アダプター、アデニル酸シクラーゼなどがある。これらの経路は転写と翻訳、酵素活性、細胞運動の変化を含む広範な細胞応答を引き起こす。
5.5 効率と特異性:多タンパク質シグナル伝達複合体の形成
●シグナル伝達経路は細胞内でタンパク質の活性に影響するだけでなく、細胞で発現されるタンパク質の種類と量も調節している。このような調節は発生、分化、そして異なる細胞での特異的機能発現に必要である。結局のところ、ほとんどのシグナル伝達は遺伝子の転写を調節し、ひいては細胞内でのタンパク質の種類と量を調節している。シグナル伝達経路の刺激が遺伝子発現プロファイルに及ぼす効果のマイクロアレイ解析により、単一の刺激は数百もの遺伝子の発現に影響することが明らかになっている。
5.6 シグナル伝達ネットワーク
●シグナル伝達経路は通常、直線状のカスケードとして描写されているが、ほとんどすべてのシグナル伝達経路は高度に相互連結した状態になっており、シグナル伝達のタイミング、強度、持続時間を動的に調節するネットワークを形成している。さらに、フィードフォワードとフィードバックの両方のループにより、シグナル伝達を自己調節したり、複数のシグナルを同時に集積できるようになっている。
6.細胞周期
6.4.3 チェックポイント
●細胞は常に、その生存をおびやかすダメージに結びつくような損傷を受けている。これらの損傷は、代謝における化学的に活性な副産物のように内因性であったり、化学物質や放射線のように外界からもたらされたりする。その結果、傷害を受けた分子を取り除き、必要な修復を行う機構が進化してきた。損傷が修復される前に細胞周期が進行することが有害であったり破滅的であったりする場合には、修復が行われている間進行を遅らせる機構がさらに進化した。これらは細胞周期チェックポイントと呼ばれる。
DNA損傷チェックポイント
DNA損傷には、化学的な付加物やDNA二本鎖切断など多くの種類が存在するが、それらはすべて増殖している細胞に似たような問題を引き起こす。すでに述べたように、DNA損傷チェックポイントが存在しない場合には、DNA複製が妨げられ誤りを起こしやすくなり、分裂期における遺伝物質の損失などが起こりうる。そのため、細胞周期の進行は3つのポイントで止められる。
紡錘体チェックポイント
分裂が起こるときは、細胞にとって危険な時期といえる。分裂においては複製された染色体が、紡錘体と双方向性に結合することにより整列し、それぞれの娘細胞が、完全な1セットの染色体を受け取るように、染色体分体を分配することが必要である。この誤りは、たいへん望ましくない結果である異数性につながる。このため、紡錘体の構築と、紡錘体への染色体の結合の過程は、綿密に監視されている。紡錘体の異常や染色体の不適切な結合に反応して前中期や中期を遅らせる機構は、紡錘体チェックポイントと呼ばれている。
6.7 細胞周期とがん治療
●がん細胞は必ず増殖するはずなので、必須の細胞周期タンパク質は治療開発の標的とされてきた。ことにCDKについては低分子阻害薬が徹底的にスクリーニングされ、そのいくつかは臨床治験に入っている。しかし、このアプローチは有効性を、in vitroのモデルでの成功以上に評価するのは早計である。進められているもう1つのアプローチは、チェックポイント反応を阻害する薬剤を開発することである。がん細胞は非常に増殖が盛んであるため、必須な制御の喪失に対して、より感受性が高いであろうと推測される。この考えは、まだ証明されているわけではない。しかし、現在多くの治療法が、遺伝子傷害性の薬剤や紡錘体阻害薬など通常チェックポイント反応の引き金となるような薬剤を用いていることは注目すべきことである。これらの治療が有効なのは、がん細胞が実はチェックポイント反応による防御機構に異常をもつためであると推測されている。
●サーカディアンリズム(概日リズム)は、がん治療と細胞周期のもう1つの興味深いつながりを示しているかもしれない。サーカディアンリズムヒトの生理の事実上すべての側面を制御しているが、細胞周期制御遺伝子の発現と細胞周期そのものは、昼と夜のサイクルに同調している。また腫瘍細胞はこの制御をほぼ失っていることも示されている。そのためこの違いは、治療のために利用かもしれない。実際、腫々の遺伝子傷害性の化学療法の許容性と有効性は、1日のうちの時間によって異なっており、これは薬剤を投与した時間と正常組織における細胞の細胞周期上の位置との関係を示唆している。細胞周期における概日制御のより詳細な理解が、現在の治療法の最適化への道筋を示すかもしれない。
7.細胞死のメカニズム
●歴史的に細胞死は遺伝学的に制御された(またはプログラムされた)機構と制御されない機構に細分されてきた。アポトーシスはプログラム細胞死の基本的なタイプであり、特異的な遺伝子と経路によって活性化され、また制御される。対照的に、壊死は無秩序な過程で、急性の物理的外傷、または、細胞が生き残りえない、極度のストレスの結果であると伝統的に考えられてきた。しかし、最近になって、“プログラムされた”と考えられるメカニズムは、壊死を調節し、壊死性の形態を表す制御された非アポトーシス性細胞死(ネクロトーシス)に終わる、特定の事例にも存在するものとして、この厳密な細胞死メカニズムの分類は再考されてきている。また、プログラム細胞死を抑止することを通して、ストレスと飢餓を耐え忍ぶためにがん細胞によって利用される代謝性のオートファジー経路のような、新しい生存機構が明らかになってきている。たとえば、プログラム細胞死の機構に欠陥を得たがん細胞は、単に“不死”なだけではなく、むしろ積極的に生存を可能にする新規の生理的状態を発動させる。
※アポトーシス
細胞の死であるが、壊死のように障害による死ではなく、生体の必要に応じた細胞死.
一部の細胞があらかじめ遺伝子で決められたメカニズムによって、なかば自殺的に脱落死する現象。アポプトーシスともいう。オタマジャクシがカエルになるときに尻尾が消失したり、脊椎動物の指の間の水掻きが胚の発生にともないなくなるなどの現象で、プログラムされた細胞死と呼ばれる。体内での器官形成でもアポトーシスの例が多く発見されており、動物の発生過程での重要な原理とされる。正常な発生過程だけでなく、ウイルスの感染や放射線被曝、薬物投与などでアポトーシスが起きることがわかっており、免疫系の細胞でも重要な役割を果している。(ブリタニカ国際大百科事典 小項目事典の解説)
こちらは「一人抄読会」さまのサイトです。疾患におけるオートファジーとして、「癌」を含め7つについて紹介されています。なお、元になった論文のタイトルは“Autophagy in Human Health and Disease”というものです。
7.1 アポトーシス
●アポトーシスによる細胞死は正常の発生において組織を形づくることに関係している。これらの発生における細胞死は指間膜やオタマジャクシの尾の除去から、免疫反応を制御するために必須な特定のB細胞やT細胞集団の選択・排除にまで及ぶ。適切なアポトーシスの制御はきわめて重要で、過剰なアポトーシスは変性疾患に結びつき、一方で不完全なアポトーシスは自己免疫とがんを助長する。さらに、アポトーシスは疾病、特にがんを抑制するための機構として、損傷を受けた細胞や病原体の感染した細胞を取り除くために必要とされる。それに対して、腫瘍や病原体もまた、自身が残存し、しばしば疾病の進行を助長するためにアポトーシスを無力にする見事な機構を進化させた。
●現存する多くの抗がん剤の効果は、アポトーシス応答を引き起こすことを伴うか、あるいは、アポトーシス応答によって促進される。したがって、アポトーシス経路の構成因子や、シグナル伝達、調節点を詳細に理解することが、腫瘍細胞にアポトーシスの能力を復帰させることをねらった、化学療法への合理的な取り組みを可能にした。腫瘍がアポトーシスを不活性化させる分子レベルの仕組みを特定することにより、アポトーシス経路を直接標的とするがんの治療が可能になった。これらの医薬品は現在臨床において、腫瘍細胞で無力化されたアポトーシスを特異的に再活性化して、腫瘍の退縮をもたらす目的で使用されている。
7.2 オートファジー
7.2.1 代謝ストレスに対する細胞の生き残りを促進するオートファジーの役割
●オートファジー(autophagy、自食ともいう)は、進化の過程で保存された、長寿命のタンパク質や細胞小器官の分解をつかさどる機構であり、リソソームの異化作用の経路で成り立っており、ストレスにより活性化される。
●ほとんどの環境において、オートファジーはアポトーシスを遅延させ、栄養性のストレスに対して代謝を維持し、障害されたタンパク質や細胞小器官の蓄積を予防して、細胞のダメージを軽減させることができるという生存経路なのである。
●最近の研究では、オートファジーが腫瘍細胞の生存を可能にしていることが、in vitroと in vivoで明らかになり、それは特にアポトーシスの不活性化された腫瘍細胞で明確であった。血管新生が不十分な場合に、オートファジーはその結果としてできる低酸素領域に局在し、そこで腫瘍細胞の生存を助けている。この栄養欠乏時のオートファジーの過程は、栄養素・酸素・増殖因子が回復した際の成長と増殖能の復旧を特筆すべき忠実度で可能にする。それゆえ、オートファジーは腫瘍の根絶に対して重要な障害になっている可能性がある。
●オートファジーは飢餓の間のエネルギー産生の代替手段を供給するだけでなく、特にタンパク質と細胞小器官の品質管理の促進を通して細胞損傷の緩和にも役割を果たす。損傷したタンパク質と細胞小器官を分解することによって、オートファジーは毒性をもちうるそれらの集積を予防する。
●細胞には、複数の死のメカニズムがあることが明らかになってきており、それらが腫瘍でどのように改変されているか、そして治療によりどう活性化されるかをはっきりさせることは必須である。分子レベルでいかにアポトーシスが制御されているか明確にすることは腫瘍細胞のアポトーシス機能を誘発するか回復することを狙った新規のがん治療の開発につながり、この進歩は継続するであろう。そのうえ、ヒト腫瘍で共通の変異がアポトーシスを不活性化させる機構を明確にすることは、腫瘍の遺伝子型特異的なアポトーシスを標的とする合理的な化学療法のための新規の機会をもたらしている。アポトーシスを不能にされている腫瘍細胞では、代替の細胞死の方法が活性化されることが明確になっており、それは壊死を含むがその過程はまだ十分明らかにされていない。オートファジーの異化作用の過程は、代謝性のストレスに対する腫瘍細胞の生存を促進でき、それは部分的に腫瘍細胞に固有の変化した代謝に乗じることによる治療的介入の新たな機会を提供している。
※代謝ストレス
グルコースやアミノ酸など、細胞が生存・増殖するために必要な栄養素が不足することでひき起こされるストレス.(実験医学 2015年7月号 Vol.33 No.11より)
※リソソーム
リソソームは、細胞内に種々の加水分解酵素を含んでいて、細胞内に取り込んだ異物や、細胞内の不要な物質を分解する。
※異化作用
異化とは、分子を小さな構成部分に分解してエネルギーを取り出す作用である。
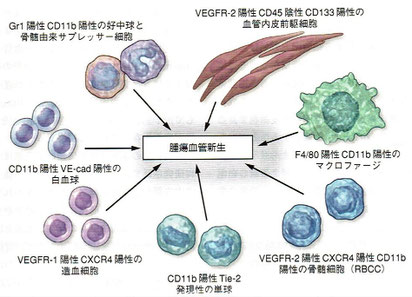
9.血管新生
9.1 序論:がんに対する血管新生阻害療法の着想
●臨床腫瘍学の分野における過去6年間で最も顕著な進歩は、米国食品医薬品局(FDA)が数種類の転移性悪性腫瘍の治療薬としていくつかの血管新生阻害薬を承認したことである。はじめ大きな期待のもとに、血管新生阻害薬に関するいくつもの大規模な第Ⅲ相臨床試験が行われたものの、ほとんど成功を収めなかった。その結果、この分野に向けられた情熱は徐々にさめつつあった。しかし、ベバシズマブ(抗ヒト血管内皮増殖因子)がランダム化第Ⅲ相臨床試験で初めての成功を収めたことで情勢が変わった。転移性大腸がんの第一選択治療においてこの分野の再興が起こり、結果として進行性の乳がんや腎細胞がん、大腸がん、非小細胞性肺がん、神経膠芽腫、肝細胞がん、卵巣がんの治療において大小程度さまざまな進歩がもたらされたのである。だが、こうして数多くの成功が収められている一方で、悪性腫瘍の種類によっては臨床試験の多くがいまだに成功していない。あるいは成功したといっても、乳がんの場合に顕著だが、わずかな臨床的有用性しか認められなかったりする。ゆえに、悪性疾患の患者の治療を進歩させるためには、血管新生の基本的な仕組みとその調節因子の探索を続行することが不可欠である。
9.2 腫瘍毛細血管形成の順序
●過去5年から10年の間に、血管形成に対する見方の修正や代わりの見方が登場した。血管形成の仕組みは発生臓器や腫瘍の種類、あるいは双方に依存して特異的である可能性がある。たとえば、脳のように血管に富んだ臓器では、増殖中の腫瘍に新たな血液供給がもたらされるうえで血管を引き込むことが重要な役割を果たしている可能性がある。
●注目すべきは血管新生過程の間、腫瘍血管内皮細胞において多数の多様な分子レベルの変化が特定されていることであり、それらの変化の多くは血管新生阻害薬開発の有望な新標的を示唆している。
9.4 腫瘍血管は機能異常を伴う
●腫瘍は新しい血管網を誘導し発達させる手立てをもっているものの、腫瘍に誘導される血管が構造上も機能上も正常血管と同じとは限らない。実際のところ、固形腫瘍内の血管にはいくつかの際立った異常性があり、それは腫瘍の増殖や進行、さまざまな抗がん治療に対する応答に大きく影響を与えていると考えられている。
9.6 腫瘍血管新生の内因性抑制遺伝子性因子
●血管新生には多数の促進分子があるだけでなく、生体内にはじめから備わる内因性の抑制因子も多く存在する。そうした抑制因子の存在は血管を欠く組織や臓器が存在したり、軟骨や硝子体のように転移が起きにくい部位があったりするという観察をもとに、Folkmanによって初めて推測された。内因性の抑制因子は、病的に陥る事を防ぐ“停止”信号が必要な生理的に起こる血管新生(創傷治癒や月経、黄体周期)において大事な役割を担っていることを認識しておくこともまた、重要である。
9.8 血管新生阻害薬の開発戦略
●現時点ではどの種類の薬剤が有望なのか(抗体なのかチロシンキナーゼ阻害薬なのか)を決めることはできない。チロシンキナーゼ阻害薬には複数のキナーゼが関係しているため、この種類の薬剤は概して多くの標的外の毒性をもたらし、一般的に抗体よりも毒性が強い。加えて、低分子量のチロシンキナーゼ阻害薬は抗体に比べて薬剤曝露の仕方が患者間でばらつきやすいと考えられる(抗体は患者の体重に応じて用量を決めるが、一方、チロシンキナーゼ阻害薬は1日何mgというような標準用量にもとづいて処方される)。
●がん治療に用いる血管新生阻害薬に関してもう1つ重要なのは“偶然発見された”血管新生抑制因子である。これは、血管新生阻害を目的に開発されたのではないが、実際には血管新生を抑制し、総体的に抗腫瘍効果を示す薬剤のことを指す。こうした薬剤には、昔から知られていたものもあれば、最近開発された新薬もある。
9.10 血管新生阻害薬・治療に対する耐性
●血管新生を促進する増殖因子にはさまざまな種類がある。腫瘍で発現する増殖因子の数と種類は、病気が進行するにつれて増加する。
●ある種の遺伝子変異が生じると、がん細胞は比較的低酸素な状態でも生き延びることができるようになる。このような状態への変化は、効果的で長期にわたる血管新生阻害治療を行っている間に起きると予想されている。
●血管新生阻害薬は比較的未熟な新生血管系に作用しやすく、完成した/より成熟した血管に対する作用は小さいか、まったく効かないという傾向がある。前臨床研究において、腫瘍モデルに血管新生阻害治療を施すと血管の成熟と再構成が促進され、治療に対する感受性が低くなることが報告されている。
9.11 腫瘍血管新生のバイオマーカーと血管新生阻害治療
●血管新生阻害薬の開発と臨床応用にまつわる難題は、他の多くの種類の抗がん剤療法、特に“標的”治療と同様、効用の向上や毒性の抑制、費用対効果の改善を含む、相対的な臨床的有用性を上げるためには予測マーカーや代理マーカーが必要だということである。大切なのは予測マーカーと代理マーカーを区別することだ。予測マーカーとは治療が効く患者と効かない患者(あるいは副産物が生じる患者と生じない患者)を特定するために治療に先んじて調べられるマーカーのことである。また、代理マーカーとは治療開始後に標的の変化、もしくはできれば臨床的有用性を評価するマーカーのことである。
9.12 血管新生阻害薬/抗VEGF薬剤にもとづいた臨床試験
●過去20年にわたった研究は血管新生過程に関して多くのことを明らかにし、さらにはその知識を、進行性悪性腫瘍の治療へ応用することに成功してきた。FDA(米国食品医薬局)によって認可された薬剤はすべてVEGFシグナル伝達に干渉して血管新生を阻害することを狙ったもので、VEGFは、血管の発達、機能、形態の制御において多様な役割を果たす。
9.13 先行きの見通し:血管新生阻害療法の新たな標的や薬剤、戦略
●新しい戦略に関していえば、可能性は膨大であり、そのなかには血管新生阻害薬を化学療法以外の治療法と組み合わせるということも含まれる。
●血管新生阻害薬と他の種類の治療法を組み合わせるさまざまな治療法が前臨床あるいは臨床段階で研究されている。
※VEGF(Vascular endothelial growth factor; 血管内皮増殖因子)
血管内皮細胞の増殖、移動、生存、透過性に関わるタンパク質で、そのシグナル伝達経路は脈管形成および血管新生に深く関与しています。
10.浸潤・転移
10.3 原発性腫瘍に転移能を獲得させる選択圧
1.低酸素
●原発腫瘍の形成過程で組織の恒常性が壊されるためには、細胞増殖を制限する多くの障害を乗り越えなければならない。ほとんどすべての腫瘍細胞が獲得すべきものとして、低酸素に対する応答がある。
2.炎症
●正常組織の恒常性や構造が破壊されると、血管の障害、低酸素領域の出現、血中タンパク質の漏出、外来病原体の侵入などが引き起こされる。
●1850年代にVirchowは、炎症ががんの原因であるとの仮説を提唱したが、一般的には炎症反応の存在は、免疫システムが、侵入してきた病原微生物やウィルスと同様に、がんに対しても活発に戦っている証拠であると考えられている。この考え方からすると、炎症反応は免疫による攻撃から逃れようとする腫瘍細胞に対して働く重要な選択圧とみなすことができ、がんの治癒することのない性質は一進一退の戦いであることを意味する。がんは免疫編集と呼ばれる過程を通して、免疫抑制的な環境を構築することで進行するのである。
※がんと免疫の関係
以下の内容は、国立がん研究センター研究所さまのサイトに出ていたものです。

『がん細胞と生体の免疫応答の関係は、がん免疫編集 (Cancer Immunoediting) という概念にまとめられています。
紫外線や放射線といった日常生活で受ける刺激によって生体に生じるがん細胞は、免疫系によって認識されて排除されます(排除相)。次第に免疫系によって排除されにくいがん細胞が発生してくるようになり、がん細胞の発生と免疫系による排除は平衡に達します(平衡相)。さらにがん細胞は、免疫系の攻撃を抑制する分子を取り込むことにより、免疫監視をくぐり抜けて増殖し、臨床的に診断される「がん」になります(逃避相)。このようにがん微小環境では、がん細胞に対する免疫系の攻撃は、さまざまなメカニズムによって抑制された状態となっています。』
11.がん幹細胞
●がん研究において、腫瘍の成長を開始できる、細胞を同定することは最重要課題の1つだが、そのような細胞は腫瘍開始細胞またはがん幹細胞(CSC:canser stem cell)と命名されている。
11.1 腫瘍の不均一性
●がんは異常細胞が無秩序に増殖し、腫瘍内のすべての細胞が制御できない状態で増殖している状態とみなされているが、腫瘍内には細胞の増殖能に関する機能的不均一性がある。
●がん幹細胞は、腫瘍開始能をもたない大半の細胞集団とは生物学的に異なる。
付記:がん細胞と自動車部品
自分なりに「がん」をイメージしてみました。ご参考まで。
人間の細胞は約60兆個(60,000,000,000,000個)です。一方、自動車の部品点数は約30,000点と言われています。60兆個の部品点数は自動車20億台(2,000,000,000台)分に相当します。
60兆個の細胞の固まりである1人の人間が生活しているということを、60兆個の部品が使われている20億台の自動車が道路を走っている状態だと仮定すると、思うことは具合の悪い自動車は「いったい何台になるだろう?」ということです。仮に0.01%(10,000台に1台)に問題ありとすると、世界で200,000台の自動車がピンチです。
対応は問題の部品を取り出し、新しい部品に交換することですが、事前に、車検や定期点検を受けていれば故障率は減らせると思います。また、交通ルールを守った安全第一のストレスのない運転をしていれば、部品を長持ちさせることはできると思います。
そして、【がん細胞≒不具合部品】とすると、部品交換はがんを取り除くための3大治療(手術、化学療法、放射線治療)であり、点検はがん検診、交通ルールを守った適切な運転は規則正しい生活習慣にそれぞれ当てはまると思います。
がんから生還されても、がんになった元の原因が改善されなければ再発が危惧されます。こう考えると、がん対策の基本は、「がん検診」と「生活習慣(食事・睡眠・運動)」、そして「過度なストレスから距離を置くこと」だろうとあらためて思いました。

画像出展:「PhotoAC」