第7章 神経変性疾患と慢性炎症
Ⅰ パーキンソン病
5.パーキンソン病:発症を源にさかのぼる
・ドイツ神経内科医のKlingelhoefer等は、パーキンソン病の予兆は運動症状が出る10年数年前に、頑固な便秘や嗅覚障害の形で起きていることを指摘し、「パーキンソン病は腸と嗅球から始まる」と2015年に結論している。
・パーキンソン病が腸の動きと密接に関係することは、1960年代から続けられた大規模疫学調査(Honolulu Heart Program)で既に報告されている。Abbott RD, Petrovitch H, White LR, et al: Frequency of bowel movements and the future risk of Parkinson’s disease. Neurology 57: 456-462, 2001
この調査では、疾患のない健康な男性6,790人が対象に選ばれ、各自の健康状態を24年間にわたって追跡記録する方式で記録が行われている。その中でパーキンソン病を発症した96人の被験者について、どんな症状が初期にあったかが調べられた。96人全員に共通した最初期の症状は、頑固な便秘と嗅覚障害であり、睡眠障害とうつ状態がそれに続く症状であること、平均して12年後にパーキンソン病の運動症状が現れていることがわかった。この調査結果は、鋭い指摘をしていたにもかかわらず、便秘はパーキンソン病の1症状に過ぎないと解釈されたため、埋没してしまった。
1997年に、パーキンソン病の病因と考えられる異常構造タンパク質α-シヌクレインについて研究が始まり、研究の進展とともに、腸の働きがいかに脳と深く関係しているかが明らかになって、Klingelhoefer等の調査結果が再評価された。
・パーキンソン病の責任病巣は黒質緻密部(SNc)であると長年考えらえてきた。しかし黒質緻密部の変性・脱落より10数年前にさかのぼると、腸には頑固な便秘という形で異変がすでに起きており、α-シヌクレインの凝集は腸神経、嗅球、顎下腺で確認されていた。腸は自律神経を介して脳と連絡している。延髄の迷走神経背側核にはα-シヌクレインの凝集が生じており、この凝集はさらに脳幹に進んで、中脳の黒質に達することが報告されている。

画像出展:「慢性痛のサイエンス」
①何らかの環境因子が引き金となって、腸内や嗅球にα-シヌクレイン凝集が起きる。
②凝集は自律神経を介して延髄の迷走神経背側核に伝播され、さらに上位脳に伝播される。
③Lewy小体に対する脳内グリアによる慢性炎症が進行し、神経細胞が徐々に変性・脱落する。これに伴って非運動症状、運動症状が起きると考えられている。
Ⅱ 慢性炎症と疾患
・パーキンソン病、アルツハイマー病、変形性関節症(OA)、サルコペニア[加齢や疾患により筋肉量が減少し、全身の筋力低下が起こること]は、慢性炎症によって疾患が引き起こされている。
・慢性炎症とは全身にくすぶり続ける低程度の炎症で、発熱も発赤も腫脹もほとんどない。しかし、気づいた時には致死的なダメージに至る反応系である。それゆえ、「万病の源」と呼ばれている。
・パーキンソン病、アルツハイマー病、変形性関節症(OA)、サルコペニア以外、慢性炎症を基盤とする疾患には、2型糖尿病、慢性肺疾患、アテローム性動脈硬化症、大腸がん、前立腺がんなどがあるが、病気を引き起こしているのは、ごくごくありふれた免疫細胞である。
1.免疫細胞とインフラマソーム
・慢性炎症を起こす主役は、マクロファージ、グリア、樹状細胞、白血球、血管内皮細胞など、自然免疫系の細胞である。
-パーキンソン病やアルツハイマー病は主に脳内グリアが関与している。
-2型糖尿病、変形性関節症、サルコペニアは主にマクロファージや樹状細胞が関与している。
・自然免系の細胞は、Nod-様受容体(NLR)を有し、DAMPs(傷害関連分子パターン)とPAMPs(病原体関連分子パターン)をパターンで検出している。
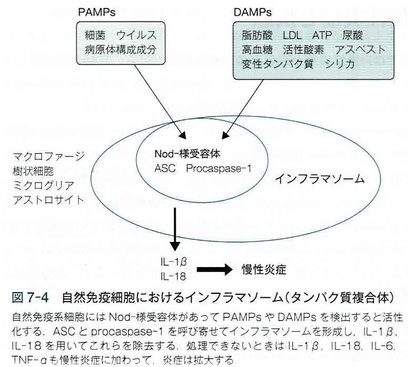
画像出展:「慢性痛のサイエンス」
PAMPs:細菌、ウィルス、病原体構成成分など
DAMPs:LDL、ATP、尿酸、高血糖、活性酸素、アスベスト、変性タンパク質、シリカなど
インフラマソーム:危険物/異物や病原体を排除するための分子装置
・『DAMPs(傷害関連分子パターン)には、LDLコレステロール、ATP、飽和脂肪酸、活性酸素、高血糖、尿酸、セラミド、アスベスト、シリカ、小胞体に正しく折り畳まれない異常タンパク質などが該当し、PAMPsには、細菌、ウィルス、病原体の構成成分などが該当する。
免疫細胞はDAMPsやPAMPsを検出すると緊急体勢に入り、図7-4のように、ASCやprocaspase-1を呼び寄せて、インフラマソームというタンパク質複合体を形成する。危険物/異物や病原体を排除するための分子装置である。
まずcaspase-1が活性化して、IL-1βとIL-8の前駆体を、成熟型のIL-1βとIL-8に変化させ、DAMPsやPAMPsに向けて放出する。危険物/異物や病原体がこれによって除去されれば、炎症反応は終了する。
しかし処理しきれない場合は、IL-6、THF-αなどの炎症性サイトカインも追加動員されて、炎症は拡大する。炎症が長期に進行している部位では、免疫細胞が顕著に集積して、組織の破壊、血管の新生、組織のリモデリング(線維化)などが、数か月から数年にわたって潜在的に進行していく。
壊死した細胞から出た、ATPやDNA、RNA、滲出した血漿グロブリン類などが二次的、三次的にDAMPsとなるため、炎症反応はカスケード状[連鎖的]に拡大し、不可逆的に進行する。炎症の矛先は重要な組織や臓器にまで及んでしまい、結果として致死的な病態に達する。
臨床上でも、体内のIL-1β、IL-6、IL-8、TNF-αなどが長期にわたって高レベルであるときは、各種のがん、神経変性疾患などの発症と関連すると報告されている。』Hotamisligil GS, Shargill NS, Spiegelman BM: Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance. Science 259: 87-91, 1993
2.慢性炎症は万病の源
・慢性炎症で注意すべきは、炎症の矛先が自身の細胞代謝にも向けられる点である。
-飽和脂肪酸、LDLコレステロール、ATP、高血糖、尿酸などは代謝産物である。
-異常タンパク質とは、アミロイド-β(Aβ)、α-シヌクレイン陽性のLewy小体などである。
・脳の代謝老廃物は、健常者では睡眠中にかなり排出され、アミロイド-βなどの沈着は少なく保たれ管理されているが、高齢期になると働きが低下する。
・『かつて医療の主体は、感染症との長い闘争であった。しかし美食と飽食の現代では、生活習慣病との格闘に移っている。内臓脂肪はわれわれが体内に溜め込んだ「内なる敵」である。ある日、トロイの木馬さながらに狂暴な反応で、われわれの体に逆襲ののろしを上げてくるのである。
以上、ありふれた免疫細胞による局所的な微小炎症が、最終的に全身に致死的な病態を作り出すことを記述した。
誤解を避けるために、ここで非肥満体の内臓脂肪について言及しておきたい。メタボリック・シンドロームの概念が社会に浸透して以来、脂肪と言えば悪、と受け取られている。しかし、非肥満体の内臓脂肪は、慢性炎症など起こしていないのである。非炎症性マクロファージM2が常在していて、抗炎症サイトカインのIL-4、IL-10、NOを生成するアルギナーゼを生成している。炎症を抑制する側で働き、食餌から得たエネルギーを細胞内に蓄積し、飢餓に備えているだけである。』
3.慢性炎症の抑制
・インフラマソームと過剰な炎症を抑制する薬物に関して、生命科学、分子生物学、分子薬理学など、多領域にわたる基礎研究が進んでいる。すでに候補はいくつか挙がっているが、完全に抑制する薬物は開発されていない。
・薬物の研究を通じ、われわれの体内には炎症を抑制する物質があることが明らかになった。それは、筋運動時に発現する転写調整因子PPAR-γと、その共活性因子PGC1-αである。
Ⅲ 認知機能障害
1.アルツハイマー病
・アルツハイマー病における脳細胞の変性や脱落は、側頭葉内側(嗅内皮質、海馬、海馬傍回などを含む部位)から始まる。患者の行動や心理的な症状を、脳画像上の灰白質密度減少との関係からみると、fMRI画像で側頭葉内側の体積低下が顕著なときは、記憶障害が顕著になり、抑うつ傾向が現れる。
・アルツハイマー病では頭頂葉も後頭葉も萎縮が及ぶ時期に一致して、感情鈍麻や妄想の症状が現れ、思考、判断、意思決定、認知などの高次機能が障害されて、人格が崩壊していく。
・特徴的に現れる症状は、アパシー(感情鈍麻、情動麻痺、動機を持った行動の欠落など)、妄想(パラノイア的な錯覚、被害妄想や誇大妄想、注意欠陥など)、うつ状態の3つである。
2.脳の時限爆弾AβとTau
・アルツハイマー病の病理の特徴は、アミロイドβ(Aβ)と呼ばれるペプチドの沈着と、神経原線維Tauの凝集が脳細胞にみられることである。
・健常者では脳組織中の代謝老廃物は、睡眠中に脳脊髄液中に排出され、血流に乗って除去されている。Rochester大学のNedergaard等は、脳には老廃物を排出するグリンパティック・システム(glymphatic system)があり、睡眠中に最も活発に機能することを明らかにした。生きた脳から、2光子顕微鏡を用いて確証を得る作業が続けられ、睡眠中には脳細胞間のスペースが増加し、目覚めているときの2倍も多く代謝老廃物が排出されると報告している。
・アルツハイマー病患者では、脳からの排出能が低下しているため、TauやAβなどが脳内に蓄積され脳内に伝播されていく。また血液脳関門の機能が障害されていて、末梢のT細胞やマクロファージが中枢神経内に侵入し炎症反応が拡大する。そのため炎症性サイトカイン(TNF-α、IL-1β、IL-17など)が脳細胞に過剰に放出されることになる。
・認知症やMCI(軽度認知障害)の患者には眠れないという共通の訴えが多いが、この訴えはとても重要である。認知症予防には、日常的に質の良い睡眠が必要である。
3.脳内グリアによる慢性炎症
・慢性炎症の反応系は、自然免疫細胞が有害物や病原体を検知し、発せられたシグナル(シグナルDAMPs、シグナルPAMPs)に基づき、炎症を起こし有害物や病原体を除去処理するシステムである。中枢神経では、ミクログリアとアストロサイトがその機能を担い、ダメージを受けた細胞や異物を除去し、脳内環境を正常に保っている。
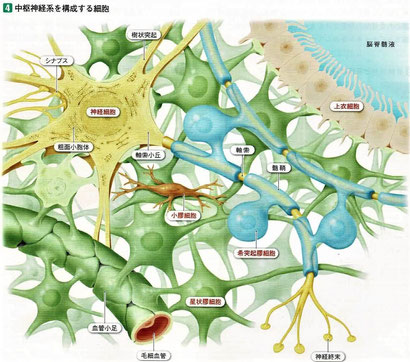
画像出展:「慢性痛のサイエンス」
アストロサイト(星状膠細胞):毛細血管壁に小足(終足)を出して神経細胞と血管の間に介在し、血液中の物質が神経組織内に移行するのを選択的に制限している。
ミクログリア(小膠細胞):単核食細胞系に属する小型のグリアである。神経組織が損傷を受けたり炎症が生じると増殖し、移動して貪食を行う。
グリア細胞(神経膠細胞)は支持細胞である:神経膠細胞は神経細胞と神経細胞の間を埋め、それらの保護・栄養・電気的絶縁に働く細胞である。
・静穏時のミクログリアは脳内をパトロールして、危険物/異物や病原体の有無を点検しており、アストロサイトは栄養物の運搬や老廃物除去などの役割を担っている。
・Aβ(アミロイド-β)やTau(神経原線維)を検出すると、ミクログリアは慢性炎症によってこれらを除去する。そして必要に応じ、炎症性サイトカイン(IL-1、IL-8、IL-17A、TNF-αなど)も追加動員し、ケモカインも呼びよせる。
・AβやTuが大量に存在してしまうと、多数のグリアが集結し炎症は拡大し連鎖反応が延々と続くことになる。
・ミクログリアには2種類あって、活性化/肥大化して炎症を促進するM1と、抗炎症作用を有するM2がある。後者は抗炎症サイトカイン(IL-4、IL-10、IL-13、TNF-βなど)を放出して、脳細胞の炎症を防ぐ役割を担っている。しかし慢性炎症が連鎖的に進行する状態では、M2はM1に変身して、炎症を促進する側にまわってしまう。
・アルツハイマー病患者の脳を組織学的に調べると、AβたTuの周りに、肥大化したミクログリアやアストロサイトが数多く取り巻いている。過剰な炎症性サイトカインに長期的に囲まれる環境では脳細胞は変性し細胞死する。
・慢性炎症を抑制する薬物について、認知機能改善の有効性が検証されている。現在、疫学調査により検証が行われているのは抗TNF-α抗体、ミノサイクリン、免疫チェックポイント阻害薬PD-1などである。長期投与した場合の安全性の確認も求められている。 Walters A, Phillips E, Zheng R, et al: Evidence for neuroinflammation in Alzheimer’s disease. Prog Neurol Psychiatry 20: 25-31, 2016
・.非ステロイド性抗炎症薬(NSAIDs)やCOX製剤については否定的な報告が多い。
・治療時期については、脳内の炎症を抑制するため、従来よりずっと早い段階で治療を始める必要性が指摘されている。
4.認知症と海馬
・アルツハイマー病における神経核の萎縮は、海馬、海馬傍回、嗅内皮質などを含む部位から始まる。それゆえ、海馬の萎縮が大きいときには認知症に移行する危険性が高いと診断される。
・長寿を全うした高齢者の脳を調べた研究では、AβやTuの凝集はみられたが、アルツハイマー病で亡くなった高齢者と比較して、海馬や大脳皮質の体積は有意に大きかったと報告されている。
5.認知症のリスクファクター
・認知症の第一のリスクファクターは加齢である。そして、他に挙げられるリスクファクターには、睡眠障害、うつ病、糖尿病、睡眠時無呼吸症候群、頭部外傷、高血圧、PTSD、肥満、動脈硬化症、パーキンソン病、sedentary lifestyle(体を動かさない不活発な生活)などがある。
・うつ病に罹患すると、若い世代でも脳内の脳由来神経栄養因子(BDNF)が減少し、海馬に萎縮がみられる。BDNFの減少は海馬に深刻な影響を与えるが、高齢者の場合は特に認知症に急速に進行する。高齢者は知人、友人、配偶者などの死に遭遇する機会が多く、うつ病の危険性が高いので、十分な配慮が必要になる。
・現在、認知症予防に最も有効なのは、日常的な筋運動である。骨格筋を動かせばPGC1-αが発現し、慢性炎症を抑制する。ニューロンの成長に不可欠なBDNF、FGF-2も筋運動によって分泌が促進される。日常的にこまめに身体を動かし、十分な睡眠をとることがとても重要である。

